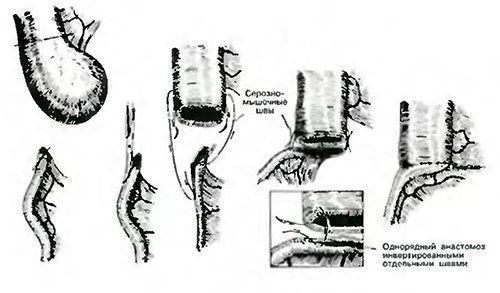
A cholestasis szindróma differenciáldiagnózisának és kezelésének újszülöttekben történő előkészítése. A gyermekek civilizációjának betegségei: több a kolesztázisról
2012. május 10-én Kazanban tartották a köztársasági tudományos-gyakorlati konferenciát „Gyermekek kolesztázis szindróma”. A konferencia közvetlen szervezője a KSMU Kórházi Gyermekgyógyászati Tanszéke (az osztályvezető, professzor V. Bulatov). A konferencián részt vettek a Tatarstani Köztársaság számos gyermekorvos, neonatológus, a kapcsolódó szakterületek orvosai - összesen mintegy 150 fő. A Tatarstani Köztársaság Egészségügyi Minisztériumának főgyógyásza, I.G. Chigvintsev, professzor A.P. Kiyasov - a KSMU tudományos és innovatív munkájának alelnöke, a Tatarstani Köztársaság Egészségügyi Minisztériumának Gyermek Köztársasági Klinikai Kórházának főorvosa Shavaliev.
 A köztársasági főgyógyász szerint Irina G. Chigvintseva Az elmúlt 20 évben sokat változott az epehólyag- és májbetegségek diagnózisában és kezelésében. „Klinikai tapasztalataink, a diagnosztikai vizsgálatok széles körének kiterjesztése sok szempontból lehetővé tette számunkra, hogy elkülönítsük a különböző betegségeket a betegségek általános osztályától. A kolesztázis szindróma csak egy. Gyakran előfordul az újszülöttek körében, és a szülés előtti időszak súlyos szövődményeivel jár, a hepatobiliaris rendszer veleszületett fizetésképtelensége. Állapotunkban, amikor a rendkívül alacsony születési súlyú gyermekek gondozásához fordultunk, a diagnózis és az időben történő kezelés problémái komoly aktuális jelentést kapnak számunkra.
A köztársasági főgyógyász szerint Irina G. Chigvintseva Az elmúlt 20 évben sokat változott az epehólyag- és májbetegségek diagnózisában és kezelésében. „Klinikai tapasztalataink, a diagnosztikai vizsgálatok széles körének kiterjesztése sok szempontból lehetővé tette számunkra, hogy elkülönítsük a különböző betegségeket a betegségek általános osztályától. A kolesztázis szindróma csak egy. Gyakran előfordul az újszülöttek körében, és a szülés előtti időszak súlyos szövődményeivel jár, a hepatobiliaris rendszer veleszületett fizetésképtelensége. Állapotunkban, amikor a rendkívül alacsony születési súlyú gyermekek gondozásához fordultunk, a diagnózis és az időben történő kezelés problémái komoly aktuális jelentést kapnak számunkra.
„Az újszülöttek és az első életnapok csecsemőiben a cholestasis szindróma a máj és az epevezetékbetegségek egyik legkorábbi megnyilvánulása. A legfőbb előfeltétel a hepatobiliáris rendszer morfofunkciós jellemzői ebben a korban. Ebben a korban viszonylag kis mennyiségű aminosav van, valamint a máj- és bélcirkuláció minden szakaszának éretlensége. A morfológiai és funkcionális jellemzők bizonyos körülmények között a kóros állapotok kialakulását sugallják ”- mondta a professzor. A kolesztázis szindróma alatt általában az epe rendszerben az epe kiválasztódásának képződményeinek megsértését értjük, ami az epe összetevőinek a vérben való növekedéséhez és a bélben nem megfelelő áramláshoz vezet. A kolesztázis szindróma jellegzetes klinikai és laboratóriumi megnyilvánulásokkal rendelkezik. A legtöbb esetben a kolesztázis szindrómát kombinálják a transzamináz enzimek fokozott aktivitásának citolízis szindrómájával, de a hepatocelluláris elégtelenség jeleivel is. A kolesztázis klinikai megnyilvánulása a sárgaság, a hepatomegalia, az Acholia széklet, a vizelet telített színe. A cholestasis szindrómás gyermekek kezelésének taktikája a kolesztázis kialakulásához hozzájáruló tényezők azonosítását jelenti, majd ki kell zárni a májbetegségeket, amelyek kezelésének hatékonysága a végrehajtásának időzítésétől függ. Ezután szükséges az alapbetegség megfelelő kezelése, a hepatotoxikus gyógyszerek és vérkészítmények kizárása vagy korlátozása, az enterális táplálkozás lehető legkorábbi kezdete, a terápiás táplálkozás megnövekedett CT-tartalmú bevezetése, 10 nap elteltével zsírban oldódó vitaminok, a hormonális gyógyszerek alkalmazása ellenjavallt. A professzor szerint az epeutak minden betegsége rendszerint extrahepatikus kolesztázisra és intrahepatikus kolesztázisra oszlik. Az intrahepatikus kolesztázisban a széklet acholiumát vizualizálják, extrahepatikus kolesztázisban - fordítva. A jelentésben a hangszóró a Byler-szindrómára is kiterjedt. A hangszóró szerint a szindrómás gyermekek a rák kialakulásának kockázati csoportját képezik. Az ASD 1-es és 2-es típusú gyermekek kezelésének taktikája (Byler-kór): a család tájékoztatása arról, hogy fennáll a rosszindulatú daganatok kialakulásának kockázata, valamint egy ismétlődő terhességgel rendelkező beteg gyermek születése. A Byler-szindrómás gyermekeket két-három hónaponként ellenőrizni kell. A támogató terápia terápiás táplálkozásból, zsírban oldódó vitaminok, mikro- és makrotápanyagok, viszketést csökkentő gyógyszerekből áll. A professzor említette az Alagille-szindrómás gyermekek kezelését. Az élet alakulása az Alairesi szindrómában a betegség lefolyásától függ, a sebészi korrekcióra tett kísérletek tévesek. Anna Vladimirovna az újszülött hepatitis, a hepatotrop kórokozók okozta májgyulladás diagnosztizálásával és kezelésével foglalkozott: a leggyakrabban opportunista. Az anyagcsere zavarokat a konferencia résztvevői is bemutatták. Ezek közé tartoznak a következők: tirozinémia, fruktozémia, az epesavak szintézisének gyengülése, progresszív családi intrahepatikus kolesztázis, cisztás fibrózis és így tovább. Ilyen anyagcsere-zavarok gyanúja lehet, ha a családi analízis olyan korábbi halálesetes eseteket tartalmaz, amelyek egy azonosítatlan kórokozóval, hirtelen halál szindrómával, egy azonosítatlan okkal rendelkeznek. Ezenkívül az anyagcsere-rendellenességek tünetei az általános állapot rendellenességei: regurgitáció, hányás, fogyás.
Ezután a KSMU kórházi terápiás osztályának vezetője, professzor VP Bulatov. Bemutatta a "Gallstone betegség gyermekkorban: a terápia differenciált megközelítése" című jelentést. „A Gallstone-kór (ICD) a civilizáció betegsége” - kezdte a professzor. A jelentés szerint a cholelithiasis (cholelithiasis) gyakorisága a 16-35 év közötti fiatalok körében nőtt, az első négy nap újszülötteinek ultrahangával, az epekövek 0,5% -ában találhatók. A cholelithiasis növekedése a diagnosztika javulásával magyarázható, és a betegség valódi növekedése a táplálkozás, a fizikai inaktivitás, a környezetromlás sajátosságaihoz kapcsolódik. A koleszterin-epekő kialakulásának oka az epehólyag összehúzódási funkciójának csökkenése, az epe-koleszterin glutinja. A professzor szerint az orális fogamzásgátlót szedő nőknél és terhes nőknél, valamint parenterális táplálkozáson vagy éhező embereknél nő az epeiszap (az epe külföldi felhalmozódása). Emellett az epeiszap képződésének tényezői közé tartozik az alacsony kalóriatartalmú étrendek alkalmazása a testsúly csökkentésére, valamint olyan betegségek, mint a mikrocita és a sarlósejtes anaemia, a májcirrózis, a vírus hepatitis. 1997-től 2012-ig 99, JCB-es páciens kezelt a Tádzsik Köztársaság Egészségügyi Minisztériumának Gyermekköztársasági Kórházában, köztük a 12-14 éves lányok. A betegek 30% -ánál az örökletes hajlamot elsősorban az anyai vonalon figyelték meg. Az ilyen betegek számára ajánlott étrend - 5. táblázat. "Ez 50% -os hatékony kezelés" - mondta a professzor. Jelentésében a professzor kiemelte a konzervatív terápia indikációit a GCB második szakaszában. Ha epeköveket észlelnek, és a hároméves kor alatti gyermekeknél nem érhető el az epehólyag, akkor csak megfigyelés javasolt. Három-tizenkét éves korban - a művelet jelzése. A serdülőkorban gyermekeknek csak várt taktika ajánlott.
A konferencia során a szakértők megvitatták az olyan témákat is, mint a kolesztázis szindróma a magzati hepatitisben, elemezték a gyermekek kolesztázisának okait, valamint az epehólyagú gyermekek kezelését.
A konferencia végén a résztvevők véleménycserét folytattak és kérdéseket tettek fel az előadóknak.
Alfiya Khasanova
JEGYZŐKÖNYV
DYNFERENCIÁLIS DIAGNOSZTIKA ÉS SZYNDROME KEZELÉSE
CHOLESTASIS NEWBORN GYERMEKEKBEN
bevezetés
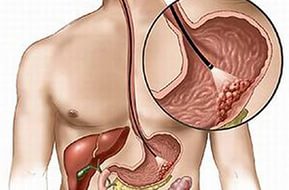
Az újszülöttkori időszakban észlelt egyik leggyakoribb anyagcsere-rendellenesség a szérum bilirubin-koncentráció növekedése. A 68 µmol / l-nél magasabb szinttel rendelkező újszülöttek sárga bőrrel és sclera-val jelennek meg. A hiperbilirubinémia az élet első napjaiban mind fiziológiai, mind patológiás okokból származhat, és ezért mindig különös figyelmet igényel. A sárgaság intenzitásának növekedése, zöldes árnyalata és a máj méretének fokozatos növekedése, a rugalmasság és a sűrűség közötti változás, az Acholia széklet megjelenése és a sötét vizelet színe a hepatobiliaris rendszer kiválasztási funkciójának megsértését jelenti - újszülöttkori kolesztázis. E szindróma laboratóriumi megerősítése a bilirubin közvetlen frakciójának növekedése a teljes szint 15-20% -ával, a koleszterin, béta-lipoproteinek (β-LPD), epesavak (FA) koncentrációjának növekedésével, valamint az alkalikus foszfatáz (AP) és a gamma enzimek szintjével. -glutamin transzferáz (GGT).
Az újszülöttkori kolesztázis-szindróma okai lehetnek a máj és az epevezetékek morfofunkcionális jellemzői, amelyekre jellemző az epesavak magas szintézise és a máj-bél-keringés éretlensége. Ezenkívül már az első élet hónapban kimutathatóak a máj és az epeutak patológiájára utaló első klinikai tünetek, amelyek kolesztázis szindróma formájában jelentkeznek.
Az elmúlt 20 évben a májbetegségek alapjainak és patofiziológiájának megértése jelentősen elmélyült. A diagnózis és a kezelés új megközelítésének bevezetése, a felhalmozott klinikai tapasztalatok lehetővé tették számos új, a nikotológiai formában kialakult formát, melyet a közelmúltig idiopátiás újszülött hepatitisnek neveztek. Figyelembe véve, hogy a veleszületett májbetegségek kezelésének hatékonysága a kezdete időpontjától függ, a korai diagnózis problémája különösen fontos.
Az újszülött kolesztázis kialakulása a hepatobiliaris rendszer betegségei, valamint a perinatális periódus nem specifikus kóros tényezőinek, azaz extrahepatikus eredetű kombinációja lehet.
A kolesztázis etiológiájától függetlenül a betegek ezen csoportjának kezelése terápiás táplálkozás, a zsírban oldódó vitaminok további bevezetése, valamint a ursodeoxikolsav cholereticus gyógyszereinek alkalmazása. A kezelés során fellépő extrahepatikus okok (átmeneti) miatt cholestasis esetében pozitív tendencia és fokozatos enyhülés áll fenn a patológiás állapotban. A máj- és epe-ürítési rendszer betegségeiben az etiopathogenetikus terápia okainak tisztázása és időben történő kijelölése érdekében a gyermekeknek speciális osztályon kell alapos vizsgálatot végezniük.
Az extrahepatikus okok miatt újszülöttkori kolesztázis.
Az újszülöttkori kolesztázis képződésének extrahepatikus okainak szerkezetét a hepatobiliáris rendszer hipoxiájának vagy ischaemia kialakulásával, a gyomor-bélrendszer hipoperfúziójával, a folyamatos hypoglykaemiával, a metabolikus acidózissal és a pangásos kardiovaszkuláris kudarcgal jellemezték. .
A bilirubin koncentráció szignifikáns növekedésének hátterében az újszülött hemolitikus betegségben szenvedő gyermekeknél a hepatobiliaris rendszer károsodott kiválasztási funkciója kimutatható. Ugyanakkor változik az epe kolloid tulajdonságai és a viszkozitás növekedése. Bizonyos esetekben a bilirubin közvetlen toxikus hatással lehet a hepatociták és a sejt mitokondrium membránjára. Fontos helyet foglal el a szisztémás és lokalizált bakteriális fertőzések. A gyulladásos mediátorok komplex kaszkádjának szintézise és kiválasztása a Kupffer sejtek, valamint a hepatociták és a sinusoid endoteliális sejtek közvetlen hatással van az epe képződésére és kiválasztására. Az intenzív osztályban és az intenzív ellátásban az újszülött által végzett terápiás intézkedések közé tartoznak a potenciálisan hepatotoxikus gyógyszerek, a teljes parenterális táplálkozás, amelyek szintén hozzájárulnak a hepatobiliáris rendszer funkcionális állapotának megzavarásához. A kolesztázis kialakulását a koraszülött újszülötteknél gyakrabban figyelték meg, több patológiai és iatrogén tényező egyidejű hatását a májfunkcióra és az epevezetékek állapotára. Ezek a változások az epevezetékekben a különböző mértékű destruktív változásokon, a hepatociták és az intercelluláris vegyületek károsodott membránáteresztő képességén alapulnak, amelyek a legtöbb esetben reverzibilisek időben történő terápiával. Az extrahepatikus okok miatt az újszülöttkori kolesztázis jellegzetessége a perinatális időszak patológiás állapotának súlyosságától és időtartamától és az iatrogén faktorok hatásától való függése. Ahogy a gyermek általános állapota javul, és az alapbetegség felbontása, a legtöbb esetben fokozatosan csökken a kolesztázis. A maradék hatásai azonban hosszú ideig, legfeljebb 6-8 hónapos életig tarthatnak. Az újszülöttkori kolesztázis diagnózisát, amely súlyos extrahepatikus patológiás szövődmény, a fejlődését befolyásoló tényezők azonosításával és a hepatobiliáris rendszer betegségeinek kizárásával állapítják meg.
A terápia ezekben az esetekben magában foglalja az alapbetegség megfelelő kezelését, a potenciálisan hepatotoxikus gyógyszerek és vérkészítmények használatának korlátozását. A legtöbb elsődleges epesavat tartalmazó koleretikus készítmény (choleenzime, flaminum, allohol és mások) alkalmazása újszülöttkori korlátait illeti, mivel ebben a korban magas toxicitású hatású.
Az újszülöttek és a kisgyermekek kolesztázis-szindrómája által kiváltott máj- és epevezetékbetegségek (1. táblázat).
1. táblázat
Az újszülöttek és a kisgyermekek kolesztázis-szindróma által károsodott máj- és epevezetékbetegségek
Extrahepatikus kolesztázis
Az extrahepatikus epevezetékek atréziája
Gyakori epevezeték ciszta
- "Epe dugók" és / vagy az epevezeték kövek
A közös epevezeték tömörítése
Intrahepatikus kolesztázis
1. Progresszív családi intrahepatikus kolesztázis (PFW)
1. típus (Byler-kór)
11. típus (Byler-szindróma)
111-es típus (MDR3-génhiány)
2. Jóindulatú családi intrahepatikus kolesztázis
3. Metabolikus rendellenességek
Alfa-1-antitripszinhiány
galaktózémia
Fruktozemiya
tirozinémia
Az epesavak szintézisének megsértése az enzimek hiánya miatt
Peroxiszomális elégtelenség (Zellweiger szindróma), \\ t
Újszülött hemokromatózis
Niemann-pick C betegség
Mitokondriális elégtelenség
4. és fertőző betegségek (vírusos, bakteriális, protozoonok okozta)
5. Endokrin rendellenességek
apituitarism
hypothyreosis
6. Kromoszóma rendellenességek
Triszómia 13, 17 vagy 18 kromoszóma
7. A teljes parenterális táplálkozással összefüggő kolesztázis
8. A gyógyszer toxikus hatása által okozott kolesztázis
9. Egyéb
Alairesi szindróma
Az intrahepatikus hypoplasia nonsyndromikus formája
Perinatális szklerotizáló kolangitis
Idiopátiás újszülött hepatitis
A hepatobiliáris rendszer károsodásának szintjétől függően szokás elkülöníteni az extrahepatikus és intrahepatikus kolesztázis által okozott betegségeket, ezek közötti differenciáldiagnózis három tünet kombinációján alapul: a széklet achólia tartóssága, a GGT vérszintje és az epehólyag vizuális megjelenése éhgyomri ultrahanggal (2. táblázat)
2. táblázat.
Az újszülöttek extrahepatikus és intrahepatikus kolesztázisa közötti differenciáldiagnózis.
A kolesztázis típusa
mutatók:
extrahepaticus
cholestasia
Intrahepatikus kolesztázis
Az acholias széklet kitartása
konstans
változékony
GGT-szint a vérben
Az epehólyag vizualizálása ultrahanggal
Nem jelenik meg
láthatóvá
GGT - gamma glutamin transzferáz, epekő - epehólyag, ultrahang - ultrahang.
Extrahepatikus kolesztázis.
Az Acholia széklet tartós jellege, a GGG enzim szérumszintjének növekedése, valamint az epehólyag vizuális megjelenésének hiánya az éhgyomri ultrahangban az extrahepatikus kolesztázis jellemző jele, amelynek oka lehet ebben a korban:
1. Az extrahepatikus epevezetékek atréziája
2. A közös epevezeték cisztája
3. "Epe dugók" és / vagy a közös epevezeték kövek.
Az extrahepatikus kolesztázis és az újszülöttkori kolesztázis leggyakoribb oka általában az extrahepatikus epevezetékek (AVZHP), amelynek jellemzője:
1. A legtöbb esetben az AVZHP teljes idejű születésű gyermekek antropometriai mutatói megfelelnek a fiziológiai normának.
2. A sárgaság az élet 2–3 napján, azaz a fiziológiás sárgaság szempontjából normálisan jelenik meg. A betegek kétharmada észrevette, hogy „fényes rés” áll fenn - a sárgaság intenzitását 1-2 életév végéig csökkentve, majd 1 hónap végéig fokozatosan növekszik és zöldes sárgaság alakul ki.
3. Aholy széklet a betegség legkorábbi és leginkább tartós klinikai jele, megjelenését gyakran megelőzi a meconium kibocsátás.
4. Az AVZHP-re jellemző, hogy a születéskor hepatomegalia hiánya a máj méreteinek növekedésével és a rugalmasságtól a sűrűségig terjedő konzisztenciája az élet első két hónapjában.
5. Az 1 hónapos életkorban kialakulhat a vérzéses szindróma (a gyomor-bélrendszer nyálkahártyáinak vérzése, a köldökzsinór, az intrakraniális vérzés), amit a K-vitamin-véralvadási faktorok (PTD vagy PTV) hiánya okoz a K-vitamin felszívódásának a bélben történő megsértése következtében.
6. Az 1-2 hónapos életkorban rendszerint tömeghiány alakul ki, amelynek súlyossága a gyermek etetésének típusától függ.
7. A betegség legkorábbi laboratóriumi jele a bilirubin növekedése a teljes bilirubin szint 20% -ánál nagyobb szérum frakció miatt.
8. A kolesztázis más biokémiai markereinek (gamma-glutamin transzferáz (GGT), β-lipoproteinek, koleszterin, lúgos foszfatáz, epesavak stb.) Növekedésével jellemezhető, melynek súlyossága a dinamikában az élet első 2-3 hetében a minimális növekedéstől jelentős növekedés 2-3 hónapra.
9. A citolízis enzimek (ALT, AST) mérsékelten növekednek, és általában késik. A legtöbb esetben a születést követő első 2-3 héten belül ezek a számok a normál tartományon belül maradnak, majd fokozatosan növekednek.
10. A máj fehérje-szintetikus funkcióját tükröző indikátorok (albumin, fibrinogén, PTI és mások) nem változnak a betegség korai szakaszában.
11. A hepatobiliáris rendszer vizualizálásának informatív módszere egy ultrahang vizsgálat, amelynek során az üres gyomorban az epehólyag nem látható, vagy „hiperhéikus zsinórként” kerül felismerésre. Bizonyos esetekben az epevezetékek atresiája az intrahepatikus epevezetékek kiterjedését mutatja, kevésbé gyakran a cátusok a máj kapujában és a poliszpleniában.
12. Hepatobiliaris szcintigráfia, retrográd cholecystocholangiography (RCPG), mágneses rezonancia (MRI) és májbiopszia további diagnosztikai értéket képvisel. Májkárosodás szcintigráfia esetén, amely az AVHP-ben szenvedő betegeknél elég nagy érzékenységet és specifitást mutat, hiányzik a bélbe belépő radioizotóp anyag, valamint a máj kielégítő felszívódási és akkumulációs funkciója. Az RHPG vezetése számos korlátot jelent a gyermekek számára az élet első hónapjaiban.
13. A májbiopszia morfológiai vizsgálata különböző súlyosságú epe vérrögöket mutat, az epevezetékek elterjedése, a portál-traktusok duzzadása és a fibrosis.
A galaktoszémia diagnózisát a megnövekedett szérum galaktóz, a vizeletben lévő redukáló anyagok, a galaktóz-1-foszfát-uridil-transzferáz enzim hiánya, az eritrocitákban, a leukocitákban és a hepatocitákban. Egy adott lókusz genetikai vizsgálata is lehetséges.
A kezelés fő módszere a galaktóz és a laktóz (Pregestimil, Nutramigen, AL110 és mások) teljes eliminációját tartalmazó étrend. A terápiás táplálkozás időben történő megkezdése a beteg teljes helyreállásához vezet. A klinikai táplálkozás hatékonyságának figyelemmel kísérése ajánlott a galaktóz - 1 - foszfát szintjének meghatározásával az eritrocitákban. Ez a metabolit 3 mg / dl-re növelhető.
A terápiás táplálkozás időben történő kijelölésével a prognózis kedvező. Ritkán előfordult májcirrózis és / vagy hepatocelluláris carcinoma. Megjegyezhető egy alacsony intellektuális index, amely elvont gondolkodásmódot, beszédet és vizuális érzékelést, izmos hypotonia-t, remegést, ataxiát és mentális retardációt mutat. Ezenkívül a nőknél a hypergonadotrop hipogonadizmus kialakulásával kapcsolatos reproduktív funkciók csökkenését írják le.
Endokrin rendellenességek. A cholestasis szindróma a hypothyreosis vagy hipopituitarizmus egyik megnyilvánulása, amely tipikus klinikai és laboratóriumi megnyilvánulásokkal rendelkezik. . A megfelelő hormonok alacsony szintje megerősíti a diagnózist. A veleszületett endokrin rendellenességek jelzik a hormonpótló terápiát.
A gyógyszerek mérgező hatása.A legtöbb esetben a kábítószerek toxikus hatásai által okozott kolesztázissal jelezhető, hogy egy potenciálisan hepatotoxikus hatóanyagot használnak, amely bizonyos mértékű a diagnózisban. Ahhoz, hogy potenciálisan hepatotoxikus gyógyszereket lehet rendelni egyes antibiotikumok (tetraciklin, eritromicin, linkomicin, novobiocin, klavulánsav, ampicillin, klóramfenikol, gentamicin, cefalosporinok 1 generációs, tienil), diuretikumok (iazix), a nem-szteroid gyulladásgátló (indometetsin), nitrofuránok (furagin 5 -Box), szulfonilamid-gyógyszerek, görcsoldók és neuroleptikumok. A mérgező májkárosodás kezelése magában foglalja a potenciálisan hepatotoxikus gyógyszerek kizárását, a cholereticus és a posyndromic terápiát.
Hosszú, teljes parenterális táplálkozás. A hosszan tartó teljes parenterális táplálkozás (SPT) okozta kolesztázis újszülötteknél diagnosztizálható, akik SPT-t kapnak több mint 2 hétig, és az idősebb gyermekeknél több, mint 3-4 hét. Az enterális táplálkozás kezdete után a kolesztázis csökkenése jellemző. Ebben az esetben a leghatékonyabb etiopatogén kezelés az enterális táplálkozás legkorábbi lehetséges kezdete, valamint a choleretic terápia.
Idiopátiás újszülött hepatitis. Az idiopátiás újszülött hepatitis diagnózisát a cholestasis szindróma minden ismert okának kizárásával és a májbiopszia szövettani vizsgálata során a hepatociták óriássejt transzformációjának azonosításával állapítják meg.
Az intrahepatikus epevezetékek túlnyomó károsodásával járó betegségek, valamint az a-1-antitripszinhiány jellegzetessége a betegek kielégítő egészségi állapota és más szervek és rendszerek patológiás változásainak hiánya. (3. táblázat). Az α-1-antitripszin hiánya az élet első hónapjában a kolesztázis szindróma, míg a tüdő kóros változásai sokkal később, 3-5 év után alakulnak ki. Az alfa-1-antitripszin és az alfa-1-globulin alacsony szérumszintje diagnosztikai érték.
Ebben az alcsoportban az Alagille-szindróma feltételesen van rendelve. Jellemzői más szervek rendellenességei és / vagy rendellenességei, de a legtöbb esetben nincs klinikai jelentőségük. Az Alairesi szindróma diagnózisa a fenotípus jellemzőinek és a más szervek 2 vagy több tipikus rendellenességének és / vagy rendellenességének azonosításán alapul.
1. Az intrauterin hypotrophia jeleinek azonosítása (súlygyarapodás a teljes idejű újszülötteknél, súlykorrekció a születéskor a koraszüléskori terhességi korig).
2. A fenotípusos tulajdonságok azonosítása (széles, kiemelkedő homlok, az arc középső harmadának hipoplazma, mély szeme, széles szeme (hypertelorizmus), hosszú, egyenes orr, vastagodás a hegyén, kiálló áll, ritka dermatoglifák stb.)
3. ECHO-KG (perifériás szűkület vagy a pulmonalis artéria hypoplasia)
4. A szemész konzultációja (posterior vagy anterior embryotoxon)
5. A gerinc röntgenfelvétele - közvetlen vetület (a csigolyák törése egy pillangó formájában).
A szindrómában kevésbé gyakori a húgyúti rendszer és más szervek rendellenességei.
A máj szúrási biopsziáját végeztük el a diagnózis megerősítésére, amelyben az intrahepatikus epevezetékek hipoplazmát észlelik. E szindróma etiopatogén kezelése hiányzik. A cirrózis kialakulásával és a bruttó szívelégtelenség vagy vesék hiányával az egyetlen radikális kezelés a májátültetés.
PSVH 3-as típus
(MDR3 génhiány)
Foszfolipidek hiánya az epében
PSVH 3-as típusú - progresszív családi intrahepatikus kolesztázis, MDR3 gén - multidrug rezisztencia gén, g. n. - epevezetékek.
Az intrahepatikus epevezeték hypoplasia kimutatása (az Alagille-szindrómára jellemző jelek hiányában) az intrahepatikus epevezeték hypoplasia nem szindrómás formáját jelzi. Az epevezeték-proliferáció kimutatásához további retrográd vagy perkután-kolangiográfia szükséges. Az epevezetékek deformitása, amit cholangiográfiával detektáltak az epevezetékek proliferációjával a májbiopszia mintájának szövettani vizsgálata során, lehetővé teszi a perinatális szklerotizáló kolangitis diagnózisát. A változások hiánya ebben a vizsgálatban egy progresszív 3-as típusú intrahepatikus kolesztázist (PFC) mutat, amit a foszfolipidek hiánya az epében igazol.
A kolesztázis szindróma tüneti kezelése
Tüneti kezelés a tartós kolesztázis szindróma és a kialakuló májcirrhosis komplikációinak megelőzésére és kezelésére
A cholestasis szindróma által kiváltott valamennyi betegségben, kivéve az extrahepatikus epevezetékek atreiáját, a közös epevezeték-cisztát és az epesav-szintézis csökkenését, a fermentopátia miatt ursodeoxikolsavval (Ursofalk) végzett choleretikus terápia. Más choleretic gyógyszerek alkalmazása az élet első hónapjaiban korlátozott a gyermekek körében, mivel sokan (choleenizmus, flamin és mások) szárított szarvasmarhákat és ezért elsődleges FA-kat tartalmaznak, amelyek kialakulása ebben a korban már magas. Az ursodeoxikolsav (UDCA) egy nem toxikus tercier epesav (FA), amelyet általában az emberi epe kis mennyiségben tartalmaz (nem több, mint 5% az epesavak teljes készletének). Ez polárisabb és hidrofilebb, mint a többi LCD. Ezek a tulajdonságok okozzák a vegyület toxicitásának szinte teljes hiányát, valamint a magas molekuláris aktivitását. Az UDCA terápiás hatásai számos alapvető mechanizmust tartalmaznak:
1. Az UDCA vegyes micellákat képez a nem-poláros hidrofób FA-kkal, amelyek jelentősen csökkenti toxicitásuk potenciálját és fokozzák exocitózisukat a kalcium-függő alfa-protein kináz aktiválásával.
2. Az UDCA bikarbonátokban gazdag kolesztereket indukál, ami az epe áthaladásához vezet, és stimulálja a mérgező FA és bilirubin kiválasztását.
3. Ennek az FA-nak a nem-poláris dimerei beágyazódnak a hepatocita membránok belső rétegébe, stabilizálva a szerkezetüket.
4. Az UDCA képes csökkenteni a toxikus és lipofil FA és az epeum más összetevőinek felszívódását.
5. Az UDCA csökkenti a fő hisztokompatibilitási komplex antigének (HLA 1. osztály a hepatocitákon és a HLA 2. osztály az epiteliális sejteken az epiteliális sejteken) expresszióját, ami a citotoxikus T-limfociták aktiválódását okozza.
Az ursodeoxikolsav készítményeket 15-20 mg / kg / nap sebességgel írják elő. Elégtelen hatékonysággal az adag 30 mg / kg / nap-ra emelhető. Hosszabb ideig tartó, 1-2 hónapnál hosszabb ideig tartó kezelés során 10 mg / kg / nap fenntartó adagot alkalmazunk.
A normális növekedési sebesség biztosítása érdekében az ilyen gyermekeknek meg kell növelniük a fehérjék és a kalóriaterhelést az egészséges gyermekekhez képest, valamint a közepes láncú trigliceridek (CTL) étrendjének tartalmát. Ebben az esetben egy fontos feltétel az étrend egyensúlya. Ezt úgy érhetjük el, hogy speciális étrendet alkalmazunk az étrendben. Ha ez nem eredményezi a kívánt hatást, a táplálkozás nazogasztikus vagy parenterális táplálkozással történik.
Az anyatej jelenlétében és a gyermek fogadására vonatkozó ellenjavallatok hiányában szükség van enzimkészítmények (CREON - 1000 U / kg / nap) megírására vagy az anyatej kombinálására a PTS-t tartalmazó terápiás keverékkel.
A szoptatás hiányában a főbb élelmiszer-összetevőkre vonatkozó gyermekek szükségletét STR vagy részleges parenterális táplálékot tartalmazó terápiás élelmiszerek alkalmazásával lehet elérni.
A kolesztázisos szindrómában (50-60%) szenvedő gyermekeknél szükséges CCT-t az emberi-orvosi keverékben, az SCR-ben, valamint a fehérje-hidrolizátumokra (Pregestimil, Alphare, stb.) Alapuló keverékek tartalmazzák. Ez a betegcsoport nem teljes mértékben indokolt, mivel a legtöbb esetben nincsenek károsodása a fehérje felszívódásában és az allergiában, és ezek a keverékek jelentősen rosszabb ízűek és magasabbak a költségek. A krónikus progresszív májbetegségben szenvedő gyermekeknél a Humana-CTC keverék alkalmazásával kapcsolatos tapasztalataink azt mutatják, hogy a betegek jól tolerálják és jelentősen javítják a táplálkozási helyzetet.
A táplálkozás egyik fontos összetevője a zsírban oldódó vitaminok és nyomelemek, amelyek hiánya minden tartós kolesztázis szindrómában szenvedő betegnél észlelhető. A zsírban oldódó vitaminok és nyomelemek ajánlott dózisai a 6. táblázat .
6. táblázat.
cholestasis szindrómával.
Cím:
dózis:
Az alkalmazás módja:
A sokaság:
D-vitamin
30 000 - 60 000 NE
* 5.000 - 8.000 NE
1 hónap / hónap
1 nap / nap
A-vitamin
25 000 - 50 000 NE
* 5.000-20.000 ME
1 hónap / hónap
1 nap / nap
E-vitamin
* 25 NE / kg / nap
peros (tokoferol polietilénglikol 1000 szukcinát)
1 alkalommal / 2 hét.
K-vitamin (vikasol)
1 mg / kg (max. 10 mg)
1 alkalommal / 1-2 hét.
1 nap / nap
Cink (cink-szulfát)
1 nap / nap
* a vérben lévő vitaminok szintjének ellenőrzése hiányában előnyben kell részesíteni az orális adagolási módot.
** az elemi Ca, Ca / F arány számításából = 2.
A cholestasis-szindrómában nyilvánvaló krónikus májbetegségek többségét pruritus kíséri, ami jelentősen rontja a betegek életminőségét. Különböző módszerek vannak, amelyek csökkentik a viszketést. Ezek különböző hatásmechanizmussal rendelkező gyógyszerek (koleszterin, rifampicin, ursofalk, heptral, stb.), Fototerápia, plazmaferezis és biliáris műtét. Szintén használhatók olyan anyagok, amelyek a bőr receptorának készülékére hatnak, mint például a mentololaj, a lanolin, a meleg fürdők stb.
A májcirrhosis szövődményei a portális hipertónia, a hepatorenális és a hepatopulmonalis szindrómák, a bakteriális peritonitis és / vagy a cholangitis, valamint a hepatikus encephalopathia. A portális hipertónia kezelése magában foglalja a só korlátozását, a vizelethajtó szerek használatát, az albumin helyettesítését a vérben, és súlyos esetekben - paracentesis. A nyelőcső és a gyomor kiterjesztett vénái a H2-blokkolók kinevezésére és bizonyos esetekben a scleroterápia végrehajtására utalnak. A hepatorenális és hepatopulmonalis szindrómák kialakulása a májtranszplantáció abszolút indikációja. Bakteriális szövődmények esetén antibiotikum terápiát végeznek. Az encefalopátiás tünetek megjelenése alapul szolgál az alacsony fehérjetartalmú étrend kijelöléséhez és a laktulóz készítmények (Duphalac, stb.) Alkalmazásához.
Így Az újszülöttkori kolesztázis a máj és az epevezetékek számos betegségének egyik legkorábbi jele, és lehet extrahepatikus eredetű is. A hepatobiliáris rendszer számos örökletes és veleszületett betegségének kezelésének hatékonysága a kezdetének időzítésétől függ, ezért meghatározza a korai diagnózis szükségességét. A differenciáldiagnosztikai algoritmus optimális listát nyújt a diagnózis létrehozásához szükséges vizsgálatokhoz a lehető leghamarabb.
Az intrahepatikus kolesztázis speciális formáját 1965-ben Clayton írta le. Jellemzője a bilirubin, az epesavak és a bróm-szulfalein szekréciójának megsértése, és a máj családi cirrhosisának fokozatos kialakulásával jár, ami halálhoz vezet. A szakirodalom tartalmaz leírásokat különböző nevek alatt: Baylera betegség, fatális örökletes intrahepatikus cholestasis, familiáris intrahepatikus cholestasis, súlyos familiáris intrahepatikus cholestasis, végzetes intrahepatikus cholestasis, progresszív familiáris intrahepatikus cholestasis, progresszív familiáris kolesztatikus cirrhosis epesav-anyagcsere rendellenesség, intrahepatikus familiáris cholestasis mentális retardáció fejlődés és növekedés. Az irodalomban rendelkezésre álló két tucat megfigyeléssel, ha szigorúan követjük Clayton elsődleges definícióját, 11 megfigyelésünket hozzá lehet adni, 6 további esetet nyilvánvalóan a családi természet hiánya ellenére is tulajdoníthatunk ennek a nosológiának.
A Byler-betegség tünetei. A kolesztázis klinikai megnyilvánulása az esetek körülbelül fele az élet első 3 hónapjában kezdődik, a fennmaradó esetek az első életévben. A kolesztázis általában hiányos. A változó intenzitású, gyakran mérsékelt sárgaságot a vizelet sötétebbé és részben acholikus ürülékkel kísérik. A pruritus mindig korai és nagyon súlyos. A klinikai képet dominálja az intenzitás és az általános állapotra gyakorolt hatása, megzavarja az alvást. A viszketés időnként változik, amikor a kolesztiramin beadása ellentétben áll azzal, amit az epehólyag-anatómiai elváltozásokkal összefüggő kolesztázissal figyeltek meg. A fenobarbitál gyakran a legjobb nyugtató hatással van a viszketésre. A máj kiterjedése, szilárd vagy szilárd konzisztenciája folyamatosan és gyorsan fejlődik.
A splenomegalia megjelenése az intrahepatikus fibrogén betegség portál megnyilvánulásait jelzi. Általában nincsenek növekedési rendellenességek vagy egyéb viszcerális rendellenességek. Az egyik gyermekünknek súlyos ricketje volt, könnyen eltávolíthatóak nagy D-vitamin dózisokkal. Ugyanakkor számos olyan súlyos ricketről számoltak be, amelyek nem nagyon érzékenyek a D-vitaminra. A K-vitamin hiány súlyos vérzéses megnyilvánulásokat okozhat.
Laboratóriumi adatok. A konjugált bilirubin szintje mérsékelten emelkedett. A minta bróm-szulfalein kiválasztásával patológiás, azonban általában a teljes koleszterin és a teljes lipid-tartalom közel van a normálhoz, még akkor is, ha a kolesztázis több hónapig tart. Ez a disszociáció a koleszterin és a lipidek késleltetése és a bilirubin tartalma között nagyon jellemző a betegségre. Williamshez hasonlóan megfigyeltük, hogy egy beteg lipidretencióval és bőr xantomával rendelkezik, és Linarelli egy esetben mérsékelt koleszterin-késleltetést észlelt. A retrospektív adatok szerint néhány betegünk, aki a betegség első évében koleszterin és lipid visszatartás nélkül volt, második alkalommal hipercholeszterinémiát alakított ki. Ennek ellenére a késleltetett koleszterin és lipidek mérsékelt jellege éles ellentétben állt azzal, amit általában az anatómiai típusú kolesztázoknál megfigyelnek. Folyamatosan megfigyelhető az alkalikus foszfatáz aktivitásának növekedése, az összes epesav tartalma mindig élesen nő.
A szabály szerint, a többi szerző és általunk megfigyelt betegnél a kolesztázis időtartama indikáció volt a laparotomia szempontjából az extrahepatikus epeutak átjárhatóságának ellenőrzésére. Mindegyik esetben a sebészeti vizsgálatot a máj, a zöld, a sima vagy már csomós felület növekedése határozta meg.
Szövettani adatok. A szövettani változások nem specifikusak: a közös portálfibrózis nagyon korán alakul ki a mononukleáris sejtek mérsékelt gyulladásos infiltrációjával. Néha a portálfibrózist kifejezett intralobuláris fibrózissal, majdnem elérő és hámló centrolobuláris zónákkal kombinálják. A portálfibrózis helyén általában nem tubuláris proliferáció van, ami megnehezíti a csövek integritásának értékelését. Ismétlődő szövettani vizsgálatokkal a betegség progresszív jellegét tükröző portális és intralobuláris fibrosis fokozatos kialakulását mutatjuk be.
A betegség lefolyása a kolesztázis súlyosbodása, időszakos, többé-kevésbé teljes körű, remissziójával. Minden súlyosbodást gyakran váltakozó fertőzés, különösen az orrnyálkahártya okoz. Ezért a kolesztázis súlyosbodásának megakadályozására adenoidektómia és mandulafélék kiváltására tettünk javaslatot. A súlyosbodást elsősorban a pruritus folytatódása jelenti, amely gyakran az első, és hosszú ideig az egyetlen kolesztaázis jele. Más klinikai tünetek néhány héttel később jelentkeznek. Hosszú exacerbációk t esetén több héttől 12 hónapig terjedhetnek. A valóságban a remisszió soha nem teljes, a hepatomegalia mindig marad. Fokozatosan, a remissziók egyre kevésbé kifejeződnek, a máj kemény, egyenetlen, noduláris, ami megfelel a biliáris cirrhosisnak. A halálos kimenetelek a dekompenzált portális hipertónia vagy a 2-15 éves kor közötti progresszív májelégtelenség miatt kialakuló gastrointestinalis vérzés miatt alakulnak ki. Ismertet egy hosszú élettartamot (20-25 év).
Néhány megfigyelésünkben egyidejűleg fennálltak a biliáris megaspanchenia, a cholelithiasis, a hasnyálmirigy kalcifikációja, vagy a laparotomiában talált krónikus pancreatitis makroszkópos képe. Általában azonban az epehólyag vagy a hasnyálmirigy kövek tünetmentesek.
A betegség családias jellege könnyen megállapítható, ha van-e több, ugyanabból a családból származó vagy a szülőkkel összefüggő vérkárosodás, ami az autoszomális recesszív átvitelre jellemző. Van is lehetőség a szórványos formákra, amelyek minden más megnyilvánulás jelenlétében nem utasíthatják el Byler-betegség diagnózisát.
kezelés. A Byler-betegség kezelése nagyon korlátozott. A kolesztiramin többé-kevésbé hatékonyan befolyásolja a viszketést, de nem gátolja a progresszív cirrogén folyamatot. A fenobarbitál tisztán tüneti hatású lehet: csökkenti a viszketést és a hiperbilirubinémia szintjét, de nem befolyásolja a súlyosbodás időtartamát vagy a betegség távoli lefolyását. Még mindig nehéz megállapítani az e tevékenységekből származó valódi előnyöket a betegek számára. Csak azt jegyezzük meg, hogy a Williams által leírt esetben a külső biliáris elvezetés is hatásos volt, míg Gray és Saunders esetében Clayton esetében a hatás ellentmondásos volt.
Az egyes esetek azonosítása a családi történelem hiányában, a betegség biokémiai jeleinek megszerzése érdekében továbbra is nehéz. Egyes szerzők szérumában olyan kóros lipokolsavat találtak, amelynek fibrogén tulajdonságai megállapításra kerültek. Ezeket a megfigyeléseket azonban nem igazolták, és eddig nem találtak kóros szérum epesókat a csoport gyermekeiben. Az epe sóinak kóros metabolizmusának hipotézise azonban a legmegbízhatóbb; további munka szükséges e betegség biokémiai vagy enzimatikus meghatározásához.
Női magazin www.
Vissza a számhoz
Progresszív intrahepatikus kolesztázis (Byler-kór)
összefoglalás
A gyermekek sárgasági szindróma a feltételek tömegéből adódik. Ha a hemolitikus, parenchimális és kevésbé gyakori gyermekeknél a mechanikai sárgaság jól ismert, az úgynevezett családi formák (funkcionális hiperbilirubinémiás szindrómák) gyakran tartoznak a casuistry részébe. Meg kell jegyezni, hogy a bilirubin anyagcsere funkcionális rendellenességeit szenvedő betegek hosszú ideig (bizonyos adatok szerint, 6 hónaptól 3 évig vagy annál hosszabb ideig) megfigyelhetők kezdetben hibás diagnózisokkal. Eközben a betegség visszahívása azt jelenti, hogy 50% -kal diagnosztizálják.
Kisgyermekeknél a kolesztázis szindróma differenciáldiagnosztikája bizonyos nehézségeket okoz. Az ilyen típusú ritka betegségek elmúlt években végzett aktív tanulmányának köszönhetően jelentős eredményeket értek el a kolesztatikus sárgaság mechanizmusának megértésében. Ebben a tekintetben fontos esemény volt Byler-betegség és a kapcsolódó betegségek izolálása.
Byler-kór kétségtelenül ritka betegség. Mindazonáltal, mind klinikai, mind patofiziológiai szempontból nagy érdeklődésre számít. Ezt a jogsértést először Jacob Byler gyermekeiben írták le, és azóta nevezték el.
Egészen a közelmúltig azonosították a „progresszív családi intrahepatikus kolesztázis” (PFHR) és a „Byler-kór” fogalmát. Ma, a molekuláris genetika fejlődésének köszönhetően, háromféle PFC létezik. Ezek közül az első Byler-betegség.
A PFHD kialakulása a hepatocita tubuláris membrán szerkezetének genetikailag meghatározott megsértése. Ennek a betegségnek autoszomális recesszív öröklődési módja van, és három típust tartalmaz (1. táblázat).
A legismertebb a PSCHV - Byler betegség. Az ilyen típusú károsodás alapja a membránhoz kötött enzim - a P-típusú ATPáz - hiánya, amely fontos szerepet játszik az epesavak transzportjában a hepatocita tubuláris membránján keresztül. Ennek következtében a primer epesavak felhalmozódnak a májsejtekben és károsítják őket.
Ugyanakkor az elsődleges epesavak nem lépnek be az epe rendszerbe és a bélbe. Ez a felszívódás romlásához vezet, beleértve az A, D, E, K. zsírban oldódó vitaminokat is.
A kolesztázis első jelei leggyakrabban már az újszülötteknél, kevésbé gyakori - 1-10 hónapos korban. az élet. Az I típusú PSPC laboratóriumi változásainak sajátossága a gamma-glutamil-transzpeptidáz (GGTP) alacsony aktivitása és a vér koleszterin alacsony szintje. Ugyanakkor a kolesztázis más markereinek indexei nőnek, beleértve az alkáli foszfatáz (alkalikus foszfatáz) aktivitást, a bilirubin közvetlen frakciójának és az epesavak szintjét.
A GGTP enzim membránhoz kötött, főleg az intrahepatikus epevezeték epitélsejtjeiben található. A szekréciót főként epesavak stimulálják, amelyek ebben a betegségben hiányoznak az intrahepatikus biliáris rendszerben. A betegség kialakulásáért felelős gén a 18. kromoszóma hosszú karjának (18q21) régiójában található.
A II. Típusú PSC-ben a chenodeoxikolsav hepatocita tubuláris membránján keresztül történő kiválasztódás túlnyomórészt a P-glikoprotein felszínén való hiánya miatt zavar. A változások patogenezise hasonló az I. típusú PSPC változásához. A laboratóriumi jellemzők szintén alacsony GGTP-aktivitást és alacsony szérum-koleszterint, a lúgos foszfatáz aktivitást. Mivel csak egy primer epesav kiválasztása sérül, az ilyen típusú áramlás kevésbé súlyos az I. típushoz képest.
A II. Típusú PVC-t a közel-keleti, grönlandi és svédországi izolált populációkban írják le. A P-glikoprotein szintéziséért felelős gén a 2. kromoszómán helyezkedik el (2q24). A gén molekuláris szerkezete hasonlít az I. típusú PSPC fejlesztéséért felelős gén szerkezetéhez.
A III. Típusú PSVH szívében a foszfolipidek (elsősorban foszfatidil-kolin) kiválasztása a hepatocita tubuláris membránján keresztül történik, ami a MDP-3-P-glikoprotein felszínén való hiányával jár.
Általában a foszfolipidek micellákban kötődnek az epesavakhoz, megakadályozzák a szabad epesavak toxikus hatását az intrahepatikus epevélsejtek epitheliális sejtjeire. A III. Típusú psvh-ben a foszfolipidek nem lépnek be az intrahepatikus biliáris rendszerbe. Ez a csatornák pusztulásához vezet az epesavak hatására. A tubulusok pusztulása a kolesztázis szindróma kialakulásához vezet, melyet a megnövekedett GGTP aktivitás és a szérum koleszterinszint jelez. Ez a fő különbség az FSP I és II típusától. A III. Típusú PSPC kialakulásáért felelős gén a 7. kromoszómán található (7q21.1).
A PSVH kötelező klinikai tünetei a sárgaság és a viszketés. Kezdetben a kolesztázist (sárgaságot) néhány hét vagy hónap után függetlenül oldják meg. Ezután fokozatosan növekszik a sárgaság intenzitása, fájdalmas viszketés. A máj és a lép jelentősen nő. Ezenkívül steatorrhea is megfigyelhető.
A sárgaság természetben szakaszos, és a visszatérő epizódokhoz társul. A kolesztázis visszaesése légúti fertőzést okozhat a felső légutakban. A sárgaságot a vizelet és a könnyű széklet sötétedése kíséri. A Byler-betegségben szenvedő betegeknél növekedési rendellenességek, görcsök és vérzéses diathesis lép fel.
A betegség korai stádiumában a szövettani vizsgálat, a máj megtartja normális architektonikáját, majd a cső alakú struktúrákat, pszeudo csatornákat képező hepatociták átcsoportosítását eredményezi. Néha az epevezetékek hiperpláziáját vagy csökkentését észlelik. A kolesztázt mind az epevezetékben, mind a hepatocitákban fejezik ki. A betegség progressziója a biliáris cirrhosis klasszikus képének kialakulásához vezet.
Ennek a betegségnek a prognózisa kedvezőtlen. A legtöbb beteg 2 és 15 éves kor között hal meg a májcirrózis szövődményeiből. Azonban az egyéni betegek, akiknek várható élettartama legfeljebb 25 év, szerepelnek. Talán a májrák cirrhosisának kialakulása.
Byler-betegség kezelése hasonló a biliáris cirrhosis kezeléséhez. A betegek általában tüneti kezelést írnak elő, amely magában foglalja a kolesztázis szindróma szövődményeinek megelőzését és korrekcióját. Az A, D, E, K vitaminokat az endogén hiány pótlására írják elő. A kalcium-glükonátot D-vitaminnal kombinálva alkalmazzák. Az előírt pruritus csökkentése: kolesztiramin (4-16 g / nap), fenobarbitál (5 mg / kg / nap), rifampicin (8-10 mg / kg / nap). Diuretikus gyógyszerek (veroshpiron, furosemid) és choleretic alapok kezelésére is használják.
Az egyik kezelés a májátültetés. Számos szerző szerint a májtranszplantáció utáni első 5-10 évben a betegek nyomon követése azt sugallja, hogy ez a módszer hatékony, és a betegség nem fordul elő.
A fentiek alapján azt mondhatjuk, hogy Byler-kór ritka örökletes betegségként jelentős diagnosztikai nehézségeket okoz. A gyermek fejlődésének késése, viszkető bőr lehet gyakran vezető és néha az első klinikai tünetek. A betegség fő diagnosztikai kritériuma a kolesztázis hullámos lefolyása, amelyben alacsony GGTP aktivitás és alacsony koleszterinszint figyelhető meg, valamint a kolesztázis más markereinek növekedése.
Az időben kezdeményezett tüneti terápia miatt a gyermek életminősége jelentősen javul, és annak időtartama nő. A kezelést nem kapó betegek fő halálozási okai a K-vitamin-hiány által okozott gastrointestinalis vérzés, de ez K-vitamin-gyógyszerekkel történő kezeléssel megelőzhető.
A Byler-betegség egyetlen radikális kezelése az ortotopikus májtranszplantáció.
A bilirubin a hemoglobin származéka. A hemoglobin tartalmú vörösvértestek (eritrociták) várható élettartama mindössze négy hónap. Ezután elpusztulnak, és új helyeket alakítanak ki. A hemoglobin, amely nincs benne az eritrocitákban, mérgező, és a test elpusztítja azt. A fehérje részt eltávolítjuk, a vasat feldolgozzuk és új vörösvértestek képződnek, és a maradékot bilirubinná alakítjuk. Annyi erőfeszítés - és mindent semmiért, mert a bilirubin még mindig mérgező, és el kell távolítani a szervezetből.
A bilirubin zsírban oldódó anyag, ezért vizelettel vagy vízzel nem oldódó anyagból álló vizelettel vagy epével nem lehet eltávolítani. Szerencsére a máj kombinálhatja (konjugált) bilirubint más anyagokkal; a kötött bilirubin vízben oldódhat és az epével együtt szabadulhat fel. Ez a bilirubin adja a széklet saját színét (és elmagyarázza, hogy miért van a máj néhány betegségében a széklet fehérvé válik). A bélben lévő bilirubin nem felszívódik. De a bilirubin egy része ismét zsírban oldódik és ismét felszívódik a vérbe. Ezt bilirubin enterális-hepatikus keringésnek nevezik.
Mindez mind a gyermek, mind a felnőtt testében történik, de nem a magzatban. A magzat nem képes levágni bilirubint epe-vel (ez nem ürül ki a méhben, bár ez a szülés során következik be, és a magzat patológiás állapotát jelzi), így a bilirubin kiválasztódik a placentán az anya májába. A placentán való áthaladáshoz a bilirubin zsírban oldható. A magzat májja nem kötődik a bilirubinhoz, mert egyébként a kötött bilirubin nem tudott behatolni a placentába, és a baba vérében marad, fokozatosan felhalmozódva a halálos koncentrációig.
A baba szülésével mindent megváltoztat a tüdőben, így tele van vízzel, most levegőt kell lélegeznie. Korábban a placentán keresztül írta az összes írást, most meg kell enni, emészteni és asszimilálni a hasznos anyagokat. Azok a vesék, amelyeknek korábban nem kellett eltávolítaniuk a mérgező anyagokat a szervezetből (amnion folyadék, sőt, a magzati vizelet ártalmatlanok, mert a magzat is ugyanaz), most meg kell kezdeni a szűrést és elszigetelést. Ugyanakkor a májnak bilirubint kötődnie kell. A legtöbb újszülött esetében ezek a változások gyorsan, egyszerre és problémamentesen fordulnak elő.
Időbe telik, amíg a csecsemő májja teljes kapacitással dolgozik, és az első néhány napban a bilirubin felhalmozódik a testében, ami a gyermek kissé elkeseredetté válik. Az a tény, hogy a máj olyan lassan indul, valószínűleg nem hiba, hanem éppen ellenkezőleg, természeténél fogva. Felnőttek bilirubin káros, de újszülötteknél antioxidánsként hat. Hasznos lehet az újszülöttek enyhe sárgasága. De nem túl erős; a magas bilirubinszint a vérben súlyos agykárosodást (bilirubin encephalopathiát) okozhat.
A természet nem tudta előre látni, hogy elválasztanánk az újszülöttet az anyától, ragadnánk a mellbimbóit és a palackjait, és csak négy óránként szoptathatná. Azok a csecsemők, akik nem szopnak egy kicsit, kevésbé kiszabadulnak, így az epeben lévő bilirubin hosszú ideig a bélben marad, és felszívódik a vérbe. A máj nem képes megkötni a bélből visszatért összes bilirubint, és a gyermek egyre dühösebbé válik. Ez az úgynevezett "szoptató sárgaság", bár egyesek úgy vélik, hogy helyesebb lenne "szoptatási hiány sárgaságnak" nevezni. A fejlődés legjobb módja a szoptatás helyes megkezdése: az első táplálkozás a kézbesítő helyiségben van, majd az anyával éjjel-nappal elhagyja a táplálékot, táplálkozik az igény szerint, és gondoskodik arról, hogy az ápolónők és szülésznők segítsék az anyát a megfelelő helyzetben.
Mivel a bilirubin kis mennyiségben hasznos a baba számára, az anyatej olyan anyagot tartalmaz, amely segít a bilirubinnak a belekben zsírban oldódóvá válni. A palackban táplált csecsemőknél a fiziológiai sárgaság teljesen eltűnik valahol egy héten belül, míg a szoptatott csecsemők néhány hétig, akár két vagy három hónapig sárgás maradhatnak. Ezt általában „szoptató sárgaságnak” nevezik. A név hülye, félrevezeti az embereket, és azt hiszem, hogy néhány év múlva valaki a nyugaton fog gondolni annak megváltoztatására. De eddig ezt kell élnem.
Néhány gyermekorvos, aki nem rendelkezik elegendő tapasztalattal a csecsemők megfigyelésére a normál szoptatás során (a közelmúltban ritkán fordult elő), olyan rettegett sárgaságtól retteg, és azt követeli meg, hogy a babát elemezzék. Ez nem szükséges. Ha a baba nagyon sárga, végezzen vérvizsgálatot. Ha a bilirubin szintje nagyon magas (18 mg / dl), akkor érdemes pár napot várni és egy másik elemzést végezni - ellenőrizze, hogy a bilirubin még magasabb lett-e. Ha a második elemzés kimutatta, hogy a bilirubin szintje csökkent, akkor nem szükséges tovább figyelni, hogyan csökken 16 és 13 között, majd 11, 8, 5, 7 és így tovább. És már világos, hogy továbbra is fokozatosan csökken, és hogy néhány hétig tart.
Az egészséges, de fennmaradó jégkorong csecsemők közel egyharmada több mint egy hónapja Gilbert-szindróma - egy öröklődő mutáció egy génben, amely befolyásolja a bilirubin kötődését a májba (ez nem betegség, Gilbert-szindrómás emberek száz évesek). A felnőttkorban Gilbert-szindróma időnként enyhe sárgaságot okozhat, ami gyakran egybeesik más betegségek, például influenza kialakulásával. A baj az, hogy amikor ez megtörténik, az orvosok pánikba kerülnek és teszteket küldenek - úgy gondolják, hogy a beteg hepatitiszben szenved. Hogy megtudja, hogy ez csak Gilbert-szindróma, és nincs semmi aggódni, egy személynek mindig van egy nagy megkönnyebbülése. Ha tudod, hogy a családodban voltak Gilbert-szindrómás emberek (vagy nem tudod, de azt hiszed - mondjuk, néhány rokon néha sárgaságot gyanított, de az orvosok nem találtak semmit), mondd el a gyermekorvosodnak.
Mivel a bilirubin eliminálódik a májban, és nem a vizelettel, több folyadék fogyasztása haszontalan. Glükóz csöpögéssel a sárgaságot nem lehet megakadályozni vagy meggyógyítani.
A vér magas bilirubinszintjeinél fototerápiát alkalmaznak. Speciális lámpák, a bőrre eső fény pusztítja a bilirubint. Ha minden, amit a babának szüksége van a fototerápiára, akkor nem szükséges az újszülött intenzív osztályba helyezni; A fényterápiás lámpák könnyedén mozognak, és szükség esetén behozhatók és telepíthetők a szobában. Ragaszkodjon ahhoz, hogy a gyermek számára megengedett maradjon. Szoptatni kell a lehető leggyakrabban - először is, a bilirubin szintjének csökkentése érdekében, másodszor, a lámpák hőéből több folyadékot igényel (általában elegendő a táplálás gyakoriságának növelése, de bizonyos esetekben szükséges lehet vízzel öntenie). Sok évvel ezelőtt úgy vélték, hogy ha egy újszülött sárgasága kezdett, akkor nem szabad több napig szopni. Néhány orvos még mindig ezt tanácsolja, bár már bizonyították, hogy nem szükséges. Azokban az esetekben, amikor a sárgaságot bármely más betegség vagy rhesus konfliktus okozza, a szoptatást nem szabad megszakítani.
Azokban az ritka esetekben, amikor az újszülött vérében a bilirubin szintje olyan magas, hogy a csecsemő valóban veszélyben van, vérátömlesztést kell végeznie, teljes mértékben a saját vérét frissen helyettesítve. A „normális” sárgaság miatt az az oka, hogy a baba egyszerűen nem kap tejet, és az orvosok az újszülött fiziológiás sárgaságát hívják (vagy parafiziológiai, azaz „szinte normális” állapot), ez rendkívül ritkán fordul elő. Azonban a sárgaságnak sok más oka lehet: a vércsoport vagy a Rh-faktor inkompatibilitása, a májproblémák, a fertőzések stb. A gyermek életkorától és a tünetektől függően az orvosok megtehetik a szükséges vizsgálatokat, hogy megbizonyosodjanak arról, hogy nincs-e semmi komoly.
Napjainkban a fototerápiát az egészséges két-három napos csecsemőknek csak akkor írják elő, ha a bilirubin szintje a vérben eléri a 20-at, a vérátömlesztés pedig 25. A korábbi időkben a fototerápiát sokkal korábban írták le, de bebizonyosodott, hogy nincs szükség rá. Beteg vagy koraszülött csecsemők esetében a sárgaság sokkal nagyobb veszélyt jelent, ezért el kell kezdenie kezelni azt korábban.
Ma a Nyugaton a szülési kórházak szabadulnak fel, mielőtt a baba időbe telik. Ellenőrizze a gyerek színét - az arc, a lábak, a szemek fehérje. Ha néhány nappal később, amikor hazatérsz, világosan látod, hogy a gyermek sárgássá vált, látogasson el a klinikára, vagy újra visszatér a kórházba. Mindig ellenőrizze a bőr színét napfényben, a lámpák fénye gyakran sárgás, és félrevezető lehet.
Sok orvosnak és nővérnek ajánlott a sárgaság elleni küzdelemre közvetlen napfényben. Ez hiba. Az anyasági kórházban a gyermekeket napfényes fényforrás lámpák alatt tartják (és csak takarmányozásra használják). A spanyol légkörben védő krém nélkül (legalább 30 egységnyi védettséggel) a babát több mint tíz percig nem hagyhatja közvetlen napfényben. Ha a napsütést a napsugárzás nélkül elhagyja egy egész órára, a gyermek komoly napégést fog keresni, de ez nem segíti a sárgaságot, mert túl kevés egy órán keresztül. Ne fordítson figyelmet az ilyen tanácsokra. A gyermeknek szüksége van fototerápiára (a kórházban, vagy ha van egy professzionális fényterápiás lámpa, otthon), vagy nem (és ezért nem kell napfénybe helyezni). Amire valójában szüksége van a gyakori szoptatásra.
Bilirubin (egységek): 1 mg / dl 17,1 μmol / l-nek felel meg.
A laboratórium különböző frakciókat határozott meg:
- Teljes bilirubin (TV).
- Nem konjugált bilirubin (B).
- Nap: konjugált bilirubin (glukuronsavhoz kapcsolódik).
- [D] -bilirubin: kovalensen kötődik az albuminnal.
- Közvetlen bilirubin: a di- és mono-konjugált bilirubin + [D] -bilirubin összege.
- A bilirubin frakciók diagramja.
Fiziológiai sárgaság: 3 napos élettel kezdődik, legfeljebb 8 napig tart. A teljes időtartamú újszülöttek maximális bilirubinszintje nem haladja meg a 17 mg / dl értéket.
Patológiai sárgaság:
- \u003e 6 mg / dl vértartalmú bilirubin.
- Icterus praecox - a bilirubin szintje az első 36 órában\u003e 12 mg / dl (200 µmol / l).
- Icterus gravis - teljes bilirubinszint\u003e 20 mg / dl.
- Az Icterus longatus (elhúzódó sárgaság) 2 hetes élet után (\u003e 14 nap) fennmarad.
Az újszülöttek sárgaságának okai
Az újszülöttek sárgasága különböző okokból eredhet, a nem konjugált vagy konjugált bilirubin szintjének növekedése alapján. A hiperbilirubinémia kialakulásához vezető állapotok spektrumát elsősorban a nem konjugált bilirubin okozza, az R.S. Chandra és J.Th. A Stacker a következő állapotokat tartalmazza.
A nem konjugált bilirubin fokozott képződése:
- az újszülött hemolitikus betegsége, az Rh tényező összeegyeztethetetlensége miatt, kevésbé - az ABO rendszer vagy más csoportok szerint;
- szepszis;
- eritrotsitopatii;
- hemoglobinopátiákkal;
- hematomák, születési trauma;
- policitémia, anyai-magzati vagy feto-anyai transzfúzió;
- gyógyszereket.
A bilirubin transzportjának megzavarása:
- hipoxia;
- acidózis;
- hypoalbuminemia;
- gyógyszerek;
- Intralipid.
A bilirubin transzportjának és konjugációjának megzavarása a májban:
- a szinuszos perfúzió csökkentése;
- gilbert-szindróma;
- sárgaság az anyatejből;
- hipoglikémia;
- hypothyreosis;
- magas bélelzáródás;
- az I. és II. típusú glükuronil-transzferázok hiánya;
- gyógyszereket.
A bilirubin máj- és bélszállításának megszakítása:
- alacsony bélelzáródás;
- meconális ileusz.
A konjugált bilirubin szintjének növekedése az alábbiak.
Extrahepatikus akadály:
- az epevezeték atresia;
- az epevezeték stenózisa;
- szklerozáló cholangitis;
- kövek;
- duzzanat;
- nyálka / biliáris dugó.
Máj patológia:
- óriássejt hepatitis;
- az intrahepatikus epevezetékek hiánya;
- szindróma (Alagilya) hepatitis;
- nem szindrómás hepatitis;
- byler-szindróma (progresszív hepatocelluláris betegség, tartós intrahepatikus kolesztázissal);
- az epesav metabolizmusának hibái (trihidro-xycoprostan acidemia).
A veleszületett rendellenességek:
- veleszületett májfibrózis;
- caroli-betegség.
Mérgező károsodás:
- teljes parenterális táplálkozás;
- szepszis;
- endoxémiától.
Kromoszóma-betegségek:
- down-szindróma;
- triszómia 17-18.
A veleszületett metabolikus rendellenességek:
- aminosavak: tirozinémia;
- szénhidrát: galaktoszémia; fruktozemiya; glikogén tárolási betegség, IV.
- lipid: Gaucher-betegség; Niemann-Pick-betegség; Wolman-betegség;
- glikolipid-hiány a, α-antitripszin.
Vegyes jogsértések:
- cisztás fibrózis;
- újszülött vas-tárolási betegség;
- indiai gyermekek cirrózisa felesleges réz tartalommal;
- cerebrohepathorenal szindróma Zellweger;
- hypopituitarismusban;
- hypothyreosis.
fertőzések:
- vírus: citomegalovírus; hepatitis B; herpes simplex vírus; Coxsackie vírus; ECHO; reovírus, III. típus; parvovírus, B 19 típusú;
- bakteriális: tuberkulózis; szifilisz; listeriosist; a legegyszerűbb; toxoplazmózis.
Szisztémás sérülések:
- langerin sejt (hisztocitózis X);
- családos erythrophagic limfohistiocytosis.
más:
- szívelégtelenség.
A bilirubin számos öröklött metabolikus szindrómát tartalmaz. A Crigler-Nayar és Gilbert szindrómák esetén a bilirubin konjugáció a nem konjugált hiperbilirubinémia kialakulásához vezet. A konjugált hiperbilirubinémia Dabin-Johnson és Rotor szindrómákban fordul elő.
Crigler szindróma - Nayar - örökletes autoszomális recesszív betegség, amely a glükuronil-transzferáz teljes hiányával vagy hiányával jár. Az újszülött sárgasága nyilvánul meg az élet második napján. A fermentopathia súlyosságától függően, és ennek következtében a szindróma hiperbilirubinémia és prognózis, I és II típusok intenzitása megkülönböztethető. A Kriegler-Nayar szindróma I-es típusában a glükuronil-transzferáz enzim teljes hiánya következik be. ami közvetett bilirubin következtében a sárgaság folyamatos növekedéséhez vezet, és az első életévben halálra ér. A májnak normális szerkezete van, vagy az epevezetékben az epe jelentős növekedése jellemzi. Az ultrahangos változások nem specifikusak. A II. Típusú autoszomális domináns öröklésnél a prognózis jobb, mivel a glükuronil-transzferáz enzim részleges hiánya van. A hyperbilirubinemia fenobarbitál és fototerápia lehetséges orvosi korrekciója, amelyet az enzim helyreállítása követ.
A Gilbert-szindróma egy olyan betegség, amelyet a közvetett bilirubin emelkedett szintje és tünetmentes kezelés jellemez. A hiperbilirubinémia oka a közvetett bilirubin behatolásának csökkenése a hepatocitákba és a glükuronil-transzferáz enzim relatív elégtelensége. A diagnózist általában serdülőkorban vagy fiatal korban végzik, amikor a betegség fokozott fizikai vagy mentális stressz, interkultatív fertőzések, böjt.
A Dabin - Johnson szindróma egy autoszomális recesszív rendellenesség, amelyben a bilirubindiglukuronid canalicularis szekréciója hiányzik. A hepatocyták a máj lebenyének középső részében aranybarna pigment granulátum lerakódásait tartalmazzák, amelyek a melanin tinctorialis jelei. Az elektronmikroszkópos vizsgálatok azonban azt mutatták, hogy ezek a granulátumok nem melanoszómák, de lizoszómák jelei vannak.
A rotor szindróma eltér a klinikailag és morfológiailag a Dabin-Johnson-szindrómától. A máj nem hisztológiailag megváltozott, de az elektronmikroszkópia éretlen biliáris canaliculusokat és osmiofil lizoszomális granulátumokat tár fel.
A kolesztatikus sárgaságot mind az intrahepatikus, mind az extrahepatikus rendellenességek okozhatják az epe szállításában és szekréciójában. Az intrahepatikus rendellenességek esetében a blokk az intrahepatikus epevezetékek, a cholangiol, a hepatociták, az epe szekréciós készülék vagy az epe-csatornák szintjén lehet. Egyes esetekben a blokk lokalizációja nem ismert. A canalicularis cholestasis mechanizmusai közé tartozik az epevezetés érzékenysége, a membrán áramlásának károsodása és a vezikuláris aktivitás, a membrán lipidek változása, a vegyületek, a hepatociták közötti kapcsolat megszakadása, az epe összetételének megszakadása a tubulusokban, az aktin mikrofilamentumok szerkezetének változása a tubulusokban.
A fentiekben felsorolt, konjugált hiperbilirubinémia okozta betegségek sokfélesége ellenére az újszülöttek kolesztázisának 70% -a újszülött hepatitisz vagy az epeutra atresia következménye.
Az újszülöttek sárgaságának szövődményei
Bilirubin encephalopathia magas szintű nem konjugált bilirubin. Akut bilirubin encephalopathia.
Korai fázis: letargia, károsodott szopás.
Közbenső fázis: mérsékelt stupor, ingerlékenység és hypertonia. A hőmérséklet és a piercing kiáltás álmossággal és hipotenzióval váltakozik. Hypertonus a nyak (retrocollis) és a hát (opisthotonus) túlzott hajlításával. Ebben a fázisban valószínűleg segíthet a helyettesített vérátömlesztés (egyetlen adat). Progresszív fázis: feltehetően visszafordíthatatlan károsodás a központi idegrendszerben, súlyos retrocollis és opisthotonus, piercinges kiáltás, szopásképtelenség, alvási apnoe, láz, mély stupor, kóma, néha görcsök és halál.
- Nukleáris sárgaság (visszafordíthatatlan károsodás) központi motoros károsodással (dyspnea és athetosis), mentális retardáció, halláscsökkenés, apnoe és fogzománchibák a fennmaradó fogakban.
- A máj kolesztázisa és cirrózisa magas konjugált bilirubinszinttel.
Módszerek bilirubin mérésére
Klinikailag (bőrszín): a sárgaság látható, kb. 5 mg / dl bilirubinszint mellett, 3-12 mg / dl ingadozás mellett. A sárgaság vizuális értékelése nagyon függ a bőr színétől, a világítástól és az orvos tapasztalatától, ami túlságosan megbízhatatlan. Ezért nem szabad figyelmen kívül hagyni a szérum bilirubin szintjét vagy a bilirubin transzkután mérését. Még olyan egészséges, érett újszülötteknél is, akik szoptattak, nyilvánvaló kockázati tényezők nélkül, a nukleáris sárgaság és / vagy a halláskárosodás alakulhat ki.
Vigyázat: a terápiát igénylő hiperbilirubinémia hiányának veszélye különösen az ambuláns ellátás vagy a szülési kórházból történő, legfeljebb 3 napos életvitel esetén jelentkezik. Ezért nagyon fontos, hogy a következő 2 (legfeljebb 3) napon belül gyermekorvos-fogadás és a betegre vonatkozó szabványos információcsere kerüljön sor.
A bilirubin szintjének perkután mérése (perkután bilirubin index (tcB-index); bilirubinométer cég Minolta vagy Bilicheck):
- a Bilicheck-et minden mérés előtt kalibrálni kell, az abszolút értékeket mutatja. Egyetlen mérés viszonylag drága;
- a módszer csak a\u003e 2500 g tömegű teljes időtartamú csecsemőkre alkalmazható, akik nem kaptak fototerápiát vagy helyettesítő vérátömlesztést.
- méréseket kell végezni a homlokon vagy a szegycsonton, a stagnáló cianózis kivételével, és a színes fajok képviselőit;
terápiás következtetéseket csak a bilirubin szérumszintjének mérése után kell elvégezni. A laboratóriumi ellenőrzés például akkor szükséges, ha:
- tcB-index\u003e 16 a nukleáris sárgaság kockázati tényezőivel;
- tcB-index\u003e 20 a nukleáris sárgaság kockázati tényezőinek hiányában;
- mindig sárgaság esetén rgaesoh (< 24 часов жизни);
- az első élethét után a kolesztázis megszüntetése.
Vigyázat: A bilirubin szintjei transzkután mérve nem standardizáltak. Az eszközök között különbségek vannak. Ezért minden eszköz esetében meg kell ismernie a perkután bilirubin index korlátait.
Tapasztalataink: a bilirubin szintje a szérum maximumban olyan magas volt, mint a perkután szint, soha nem volt magasabb.
Laboratóriumi módszerek
A bilirubin frakciókat (teljes bilirubin, nem konjugált és konjugált bilirubin) számos klinikán mérjük reflektív spektrometriával (Kodak Ektachem). Újszülötteknél és koraszülötteknél (technikai problémák miatt) meghatározható az ún. „Újszülött bilirubin” (Bing, konjugált és nem konjugált bilirubin). Mivel az újszülötteknél a bilirubin fő része általában nem konjugált bilirubin, ez a szint terápiás döntések meghozatalára használható.
Számos helyen a konjugált és nem konjugált bilirubin szintjének rutinszerű és vészhelyzeti meghatározására szolgáló analitikai rendszerek nincsenek telepítve. Ebben az esetben a teljes bilirubint diazo reagens és reakció gyorsító (koffein) alkalmazásával lehet meghatározni, és a közvetlen bilirubint gyorsító nélkül mérni. Közvetett bilirubin a két bilirubin különbsége.
Az úgynevezett "újszülött bilirubin" meghatározása egy nagyon egyszerű módszer, alacsony költségű, lehetséges a teljes vérből, de nagyon érzékeny az interferenciára. A helyettesítő vérátömlesztés indikációit nem csak a "újszülött bilirubin" szintjével lehet meghatározni.
A gázelemző készülékkel mért bilirubin jól korrelál a biokémiai méréssel 15 mg / dl (250 μmol / l) szintre, és ezért a kis minta térfogatának köszönhetően nagyon alkalmas a jégkori gyermekek szűrésére.
Vigyázat: a kolesztázt nem lehet diagnosztizálni és értékelni az ún. "Újszülött bilirubin".
Minimális diagnózis:
- Az anya és a gyermek vércsoportja, beleértve az Rh tényezőt is.
- A közvetlen Coombs-reakció és a teljes fehérje vagy albumin egy gyermekben.
- Családtörténet.
- Ellenőrizze, hogy a TSH szűrővizsgálatot végez-e. Ellenkező esetben meg kell határozni a TSH-t, a szabad T4-et, a T3-at.
- Vizsgálat: hematomák, cephalhematoma stb.
Vigyázat: Ha fertőzés gyanúja áll fenn, végezzen vizeletvizsgálatot.
Bővített diagnosztika:
- Alternatívak: Neonatális és gyermekgyógyászati intenzív társadalom kiemelt helyei: Leitlinien GNPI.
- Az elhúzódó sárgaság (Icterus longatus): gyanús metabolikus rendellenesség.
- Kolesztázis: a konjugált bilirubin a teljes bilirubin legalább 10% -át teszi ki kettős meghatározással vagy 2 mg / dl feletti szinttel.
A hiperbilirubinémia kritikus értékelése
Egészséges újszülöttek, akiknek nincs kóros hemolízise: sokáig megvitatták a fiziológiai és patológiás sárgaság és ennek megfelelően a fototerápia és a cserélhető vérátömlesztés közötti különbséget. A helyzet sokféleképpen leegyszerűsödött, mivel jelenleg „A neonatális és gyermekgyógyászati intenzív társadalom társadalmának főbb rendelkezései: Leitlinien GNPI, amely nagyon szorosan tükrözi az Amerikai Gyermekgyógyászati Akadémia ajánlásait. Az ajánlások a teljes bilirubinszinten alapulnak.
Számos tények azt mutatják, hogy ezek a korlátok 35 évnél idősebb terhességi korú csecsemőknél is alkalmazhatók, testtömegük\u003e 2000 g, valamint ABO-inkompatibilitás.
Fokozott a kockázata annak, hogy a nukleáris sárgaság fejlődik:
- A Rh-inkompatibilitás miatti hemolízis.
- Hypoxia, acidózis, hipoalbuminémia, hipoglikémia, hipotermia, szepszis.
- Olyan gyógyszerek alkalmazása, amelyek a bilirubint az albuminnal nem érintik (például ceftriaxon, digoxin, lasix, valium, teo-filin, koffein, ibuprofen!).
- A glükóz-6-foszfát-dehidrogenáz hiánya Crigler-Najar szindrómával kombinálva.
Újszülöttek sárgaságának diagnózisa
A klinikai és biokémiai adatok nem mindig teszik lehetővé a sárgaság megkülönböztetését a nem obstruktív elváltozások és az extrahepatikus epevezetékek elzáródása miatt. Ezért gyakran szükség van a májbiopszia igénybevételére, ami lehetővé teszi a diagnózis helyes megállapítását az esetek 90-95% -ában. Az újszülöttek májjai viszonylag sztereotip módon reagálnak a különböző sérülésekre, és a cholestasis esetében a legtöbb gyermek a hepatociták óriássejt-transzformációját mutatja. Ugyanakkor a szignifikánsan megnagyobbodott hepatocita négy magot tartalmaz vagy többet tartalmaz, heterogén citoplazmával rendelkezik, ahol az anyag sűrűsége és tömörödése van. A citoplazmában gyakran észlelik az epe pigmentet, a lipofuscinot és a vasat. Az óriássejt-transzformáció más sejtek számát érinti. Leggyakrabban 3 hónapos korban észlelhető, ezután jelentősen csökken az óriássejt-transzformáció detektálásának gyakorisága. Bizonyos vírusfertőzésekben a hepatociták óriássejt-transzformációjának diagnosztikai specifitását illetően az előző nézet hibásnak bizonyult. A hepatociták hipercelluláris átalakulását ténylegesen megfigyelték az újszülöttek összes kolesztatikus szindrómájában, beleértve az epevezetést, az újszülött hepatitist, a különböző fertőzést, az anyagcsere-rendellenességeket, az α 1 antitripszinhiányt és az intrahepatikus epevezeték szindrómákat.
Az újszülött hepatitisz az ismeretlen természetű újszülöttek májbetegsége. Idiopátiás obstruktív kolangiopátia néven is ismert, ahol szokás, hogy neonatális hepatitisz, epeutra atresia és közös epevezeték-ciszta eseteit foglalja magában. Azt feltételezzük, hogy a kezdeti károsodás a hepatobiliáris rendszer bizonyos szintjén gyulladáshoz vezet, hepatocelluláris rendellenességek túlsúlyával, újszülött hepatitiszként, és az extrahepatikus epevezetékek károsodásának túlsúlya, amely az epehólyag atresiájaként jelenik meg.
A vírusok intenzív keresése nem eredményezett eredményeket, azonban feltételezhető, hogy a III. Típusú reovírus szerepe a kolesztatikus hepatitis szindrómákban és az epehólyag-atresiában van.
Makroszkóposan a máj nagyítható, általában sima felületű és sötétzöld színű. A szövettani szempontból a kolesztázist általában hepatocitákban és a máj lebenyének középső részének epevezetékében észlelik, ritkán az interlobuláris epevezetékekben, és a hepatociták óriási sejt transzformációja is van. A hepatociták is lehetnek ballon degenerációban, acidofil nekrózisban. Megfigyelhető a pszeudo-vas szerkezetek kialakulása. A mononukleáris sejteket ritkán találják mind a májban, mind a portálban. Az extramedulláris eritropoiesis általában kimutatható. A portálterületek általában nem tágulnak, az epevezetékek normálisak, vagy nehézségekkel detektálhatók. Alkalmanként az interlobuláris epevezetékek mérsékelt proliferációja figyelhető meg. A betegség prognózisa jó. A gyógyulás általában megfigyelhető, és a tartós májbetegség időnként lehetséges.
A családi kolesztázis számos szindrómával társult, amelyek közé tartozik az Alagille-szindróma, a Byler-szindróma, a norvég kolesztatikus szindróma, a jóindulatú visszatérő kolesztatikus szindróma és az észak-amerikai indián kolesztatikus szindróma. Újszülöttek és csecsemők esetében a leggyakoribb a Byler-szindróma. Az öröklés típusa autoszomális recesszív. A patológia a májra korlátozódik. A kolesztázissal kapcsolatos extrahepatikus megnyilvánulások. A patológiás változások az óriássejtes hepatitiszre redukálódnak, amely egyes esetekben az intrahepatikus epevezetékek hiányával párosul. A betegség gyorsan fejlődik a biliáris cirrhosisba, a betegek ritkán felnőttkorban élnek. Az elektronmikroszkóppal cholestasis és mitokondriális rendellenességek is megfigyelhetők, amelyek azonban nem pathognomonikusak.
Az észak-amerikai indián kolesztázis, amelyet az északnyugati Quebec-i indián törzs tagjai ismertetnek, az élet első heteiben nyilvánul meg. A májbiopsziában az újszülött hepatitisz képe látható. Az elektronmikroszkópos vizsgálat a perikális terület sűrűségét mutatja az aktinszálak felhalmozódásával, ami valószínűleg az epe szekréciójának megsértéséhez vezet. Idővel a betegség mikronoduláris cirrhosis kialakulásával jár, ami halálhoz vezet.
A teljes parenterális táplálkozásban a gyermekeknél a kolesztázis legjelentősebb kockázati tényezői a kis terhességi korú és a születéskori súlyú koraszülés. A betegség gyakorisága a parenterális táplálkozásra fordított idő növekedésével nő. Ha 60 napnál hosszabb, a kolesztázis kockázata 80%. A kolesztázis valószínűsége a gyomor-bél traktus patológiájának (nekrotizáló enterokolitisz, gastroschisis) vagy bél reszekció jelenlétében is növekszik. A betegség legkorábbi markere az epesavak szintjének emelkedése a szérumban, amely 5 nappal a parenterális táplálkozás megkezdése után rögzíthető. A hiperbilirubinémia általában csak az infúzió kezdetétől számított 3-4 hét után jelentkezik.
A májban a szövettani változások a kolesztázist jelentik, mind az hepatocitákon belül, mind az epe kapillárisokban, ami különösen a máj lebenyének középpontjában van. Hemorrhagiás disszociáció, hepatocita ballon dystrophia, Kupffer-sejtek hyperplasia lipofuscin jelenlétével is megfigyelhető. A hepatocitákban meghatározzuk a vasat. Óriássejtek és pszeudoacináris transzformációk léphetnek fel, és a hepatociták nekrózisának szétszórt fókuszai fordulnak elő. Megfigyelhető az extramedulláris eritropoiesis és a fokális mérsékelt vagy súlyos lymphocytás infiltráció, melyet néha neutrofil és eozinofil leukociták keveréke tartalmaz. Az epevezeték elterjedése ugyanaz lehet, mint az extrahepatikus elzáródásnál. A steatosis ritka. Az elektronmikroszkópia az epe-kapilláris expanziót mutatja az epe túlcsordulásából, a mikrovillák elvesztéséből, a sima endoplazmatikus retikulum hipertrófiájából, amely gyengén elektron-sűrű anyagot tartalmaz, a kollagénszálakat a Disse terekben.
A legtöbb esetben az enterális táplálkozás helyreállítása után a kolesztázis klinikai és morfológiai jelei eltűnnek. Azonban lehetséges a cirrhosis és a májelégtelenség kialakulása.
A bronchopulmonalis diszpláziában szenvedő gyermekeknél a teljes parenterális táplálkozás egy másik szövődménye az epe-stázistól származó cholelithiasis.
Újszülött sárgaság a fertőző betegségekben. A neonatális időszakban a fertőző természetű máj gyulladásos betegségeit vírusok, baktériumok és protozoonok okozhatják. A fertőzés módszerei: transzplacentális, intrapartum, postnatalis.
Az újszülöttkori sárgaság okai között gyakori az újszülött vírus hepatitis. A herpeszvírusok, a rubeola vírusok, a citomegalovírus, valamint az A és B hepatitis vírusok a legnagyobb jelentőséggel bírnak.
A herpesz vírusfertőzése általában 4 és 6 nap közötti korban jelentkezik. A fertőzés gyakran előfordul az anyából, akinek a betegség tünetei hiányoznak, szintén lehetséges transzplacentális fertőzés. Vannak hepatomegalia és sárgaság, súlyos esetekben a DIC fejlődik. A májkárosodás makroszkópos képe nagyon jellemző - számos, 1-2 mm átmérőjű fehér fókusz van meghatározva. Szövettanilag ezek a koagulációs nekrózisok fókuszai, amelyek körül a hepatociták I. és II. Típusú herpeszes zárványokat tartalmaznak. A „üres mag” típusú hepatocitákban bekövetkező változások gyakoribbak. A fertőzés immunhisztokémiailag bizonyítható.
A rubeola fertőzése intrauterin. Az újszülöttnek általában alacsony a születési súlya, gyakran hepatosplenomegalia, sárgaság és thrombocytopenia, valamint a szív- és érrendszer és a szem károsodása. A májban a szövettani változások hasonlítanak az újszülött hepatitis megjelenéséhez. Az epevezeték-proliferáció és a portálfibrózis később kimutatható.
Cytomegalovírus-fertőzés esetén a fertőzés a vér vagy annak termékei transzfúziója során a transzplacentális úton, intranatálisan vagy a fertőzött szekrécióval történő születés után léphet fel. A klinikai tünetek hiányozhatnak vagy sárgasággal és hepatosplenomegáliával rendelkezhetnek. Korai intrauterin fertőzés esetén alacsony születési súly, mikrocefhalia, agyi meszesedés, chorioretinitis és thrombocytopenia figyelhető meg. A máj szövettani vizsgálata az újszülöttkori kolesztázis jelei mellett feltárja az epevélium epitéliumának jellegzetes citomegalovírus metamorfózisát ("cytomegal") és kevésbé gyakran hepatocitákat. Elektronmikroszkóppal és immunhisztokémiai módszerrel a vírus citomegalovírus sejtek hiányában azonosítható. A májkárosodás klinikai megnyilvánulása minimális lehet, ritkán nem cirrhotikus portális hipertónia alakul ki. A cytomegalovírus fertőzés és az epehólyag atresia, valamint az intrahepatikus epevezetékek hiánya kapcsán beszámoltak.
A hepatitis A és B vírusok az újszülött hepatitis ritka okai.
A hepatitis A - RNS-t tartalmazó hepatitis A vírus okozója, amely az enterovírusok csoportjába tartozik. A fertőzés enterálisan fordul elő, az inkubációs idő 2-7 hét. A vírusnak citolitikus hatása van a hepatocitákra. Az első életévi gyermekek általában nem járnak hepatitis A-val. Újszülötteknél a fertőzés vérátömlesztésen keresztül fordulhat elő, de általában tünetmentes.
A hepatitis B transzmissziója a terhesség harmadik trimeszterében akut hepatitisben szenvedő anyáknál, vagy abban az esetben, ha az anya HBsAg hordozó. Az újszülötteknél a tünetek általában hiányoznak, de HBsAg-pozitívvá válnak, és enyhén megemelkedhetnek a transzaminázszintek. Idővel ezek a gyermekek krónikus aktív hepatitisz kialakulását eredményezhetik a májcirrózisban és a hepatocellularis carcinoma kialakulásában. A betegek kis száma akut hepatitisz kialakulását, beleértve a fulmináns formáját is.
Az akut virális hepatitis szövettani megnyilvánulása a máj lebenyének és gyulladásának bomlása. A hepatociták károsodását a léggömb dystrophia és az egyes sejtek nekrózisa jelenti a acidofil Cowsilmen testek jelenlétével. Az egyidejű regeneratív aktivitás a mitózis és a binukleáris és multinukleáris sejtek jelenlétében nyilvánul meg. A sejtes beszivárgás mononukleáris, és a hurok és a portálok között található. A portálterületek egyenletesen infiltrálódnak a limfocitákkal. A plazma szekréciók, ceutrofilek és acidofil granulociták jelen lehetnek. A beszivárgás elterjedhet a lebeny periportális részén, de a krónikus aktív hepatitistől eltérően a periporgalis nekrózis nem jellemző, és minden portálterület egységesen érintett. A sinusoidokat magában foglaló sejtek hiperpláziája van, a Kupffer sejtjei lipofuscint töltenek be.
A májbiopszia vizsgálatában a vírus hepatitis B közvetett markereit lehet kimutatni. Ezek közé tartoznak a matt-üveges hepatociták, a hepatociták „homok” magjai, Caunsilmen borjú. A hagyományos mikroszkóppal rendelkező matt-üveges hepatocitáknak nagy sejtek jelennek meg egy halvány eozinofil finom szemcsés citoplazmával, melyet a sejtmembrán egy könnyű peremmel elválaszt, a mag a sejtmembránra tolódik. Az ilyen sejtek azonosításához a Masson trichromos festési eljárást alkalmaztuk az eponba záródó félig vékony szakaszokra, és toluidin kékre festettük. Az ilyen hepatociták citoplazmájában általában a HBsAg antigént különböző módszerekkel detektáljuk. A leírt nukleáris változások a HBcAg antigénre jellemzőek. Taurus tanácsos apoptotikus test. Ezek homogén eozinofil citoplazmával rendelkező, lekerekített formációk, amelyekben a mag hiányzik, vagy maradványait nyomon követik. Lokalizáció: májsugarak vagy sinusoidok lumenje, ahol a Kupffer sejtek fagocitálhatnak. Fertőző mononukleózisban, herpeszes májbetegségben is kimutatható.
A vírus hepatitis következő klinikai és anatómiai formáit különböztetjük meg: akut ciklikus (icterikus); anicteric; nekrotikus (rosszindulatú, fulmináns); kolesztatikus és kolangiolitikus; krónikus.
Az akut ciklikus forma - a máj megnagyobbodik, szövete lezárt, piros (nagy vörös máj). Szövettani szempontból: a Kupffer-sejtek sokasága, duzzanata, proliferációja, a portál traktusok hisztololphocytás infiltrációja. A hepatociták sértetlenek, vagy szemcsés disztrófiájuk van. Az elektronmikroszkópia vírusokat tár fel a sejtekben, a hepatociták fehérjeszintetizáló funkciójának növekedését, hipertrófiát és mitokondriális duzzanatot, hipertrófiát és riboszóma hiperpláziát. A sárgaság, a vacuolar megjelenésével a hepatociták léggömb degenerációja a colliquational necrosis vagy a hyalinovacapal degeneráció, a koagulációs nekrózis kimenetelével járó kimenetelével nő. A Kaunsilmen apoptotikus testei, amelyek a perisinuszoid térben találhatók, azonosíthatók. A hepatociták fókális nekrózisa Buchner-csomók kialakulásához vezet (Kupffer-sejtek makrofágreakciója) és a retikuláris stroma összeomlása a későbbi szklerózissal. A kolesztázist, a portális traktusok és a lymphoid máj lobulusok hisztololphocytás infiltrációját figyelték meg. Anicterikus forma - a ciklikus forma előtti időszakára jellemző változások.
A malignus vagy fulmináns, a masszív máj nekrózis által jellemzett forma. A kolesztatikus és a cholangiolitikus formákat az epe-trombus jelenléte az epe kapillárisok lumenében és az intracelluláris kolesztázisban fejezi ki, általában a kolesztázist cholangiolitis, cholangitis, periholangitis kombinációjával kombinálják. Megjegyezzük a lebenyek és a portális traktumok infiltrációját a limfocitákkal és a polimorfonukleukocitákkal.
A krónikus forma egy megoldatlan gyulladásos májbetegség, amely több mint 6 hónapig tart. A diagnózishoz májbiopszia szükséges, meghatározva a hisztológiai aktivitás indexét és a folyamat stádiumát. A folyamat aktivitását a hepatociták nekrózisa és disztrófiája, a gyulladásos infiltráció, a sinusoidok változása és az epevezetékek károsodása határozza meg. A folyamat szövettani aktivitásának és stádiumának (fibrózis súlyosságának) felméréséhez számos számviteli rendszer létezik. Figyelembe véve a krónikus virális hepatitis gyermekkori diagnózisának rendkívüli ritkaságát az első életévben, ebben az útmutatóban nem sorolják be a rangsorolási rendszereket, ezek számos betegkönyvben és monográfiában állnak rendelkezésre.
A bakteriális hepatitis általában a szepszis megnyilvánulása (gyakrabban opportunista flóra). A diffúz bakteriális hepatitis és a tályogforma szövettani szempontból megkülönböztethető többszörös vagy mikronoduláris tályogokkal.
Az újszülöttek (gyakran nem született) veleszületett szifilisz - egy szürke, rosszul határolt területet a jobb lebeny kapszulája határoz meg, amely egyfajta sűrű, fehér, szálas szövetet tartalmaz a bemetszésben, amely teljesen helyettesíti a parenchymát. A sérülés gyakoribb típusa a diffúz szifilitikus intersticiális fibrosis.
A veleszületett toxoplazmózis - a máj szövettani vizsgálata biliáris stáziát, hepatocita disztrófiát, fókális nekrózist, limfocitákból, hisztocitákból, neutrofilekből és eozinofilekből származó periportális infiltrációt tár fel. A pszeudociszták vagy toxoplazmák immunfluoreszcenciával detektálhatók.
Az újszülöttek fiziológiai sárgasága
A fiziológiai sárgaságot nem minden újszülöttnél regisztrálták, de nagyobb figyelmet igényel. Általában a májsejtek enzimrendszerei éretlensége miatt az úgynevezett magzati hemoglobint tartalmazó (vérben szintetizált) vörösvértestek felgyorsult bomlása miatt a gyermek bilirubinszintje megemelkedik a vérben, és bizonyos koncentráció elérésekor a bőr mérsékelten sárgul. A sárgaság az élet második napján észrevehetővé válik, míg a nyálkahártyák és a sklerák sárgára válnak, de a széklet és a vizelet a szokásos színben marad.
A széklet tömegének elszíneződése (elszíneződés), sötét vizelet és sárgaság kialakulása az élet első napjától, a sárgaság sárgulása vagy eltűnése utáni újbóli növekedés, a sárgaság visszatartásának időtartama a teljes időtartamú 10 napnál és a korai csecsemőknél 20 nap, jelzi az eljárás patológiai jellegét. Ezek a tünetek a gyermek súlyos vizsgálatát igénylik a diagnózis tisztázása érdekében.
Sárgaság kezelése újszülötteknél
Egészséges, érett újszülöttek:
A Coombs-teszt negatív, nincs csoport-összeférhetetlenség:
- A transzkután bilirubin gyorsan növekvő szintje - a szérum bilirubin szintjének ellenőrzése.
- Súlyos hiperbilirubinémia esetén: ismételje meg a Coombs-tesztet.
- Lehetséges további diagnózis.
Coombs teszt pozitív és / vagy csoportképződés, Rh összeférhetetlenség:
Vigyázzon a hamis pozitív Coombs-tesztre az anti-B profilaxis eredményeként a terhesség 28 hetében.
Az anyatej sárgasága:
- „Korai megjelenés”: a mellkashoz való elégtelen csatlakozás és „glükózzal történő táplálás”
- „Késő megjelenés”: magas bilirubinszint esetén, 24-48 órán keresztül, kifejezze az anyatejet, és táplálja a babát a mesterséges tápláláshoz. A 3. napon a bilirubin szintje jelentősen csökken, ami azt jelenti, hogy a szoptatás folytatódik. Ügyeljen arra, hogy meggyőzze az anyát a szoptatás szükségességéről.
- Távolítsuk el az epevezetékek atresiáját (a konjugált bilirubin szintjének emelkedése)!
Vigyázat: „Az anyatejet sárgasága” a kizárás diagnózisa.
Beteg újszülöttek és koraszülöttek:
Megnövekedett kockázat a vér-agy gátlásával, például acidózissal (pH< 7,25), гипотермии, гипопротеинемии (общий белок < 5 г/дл), при неврологической патологии.
A pontos határértékek ismeretlenek, minden érték tisztán empirikus.
Vigyázat: nagyon éretlen koraszülötteknél megvitatják a bilirubin „radikális csapdának” (a koraszülés retinopátiája elleni védelem) védőhatásának lehetőségét.
A koraszülött csecsemők között a cserélhető vérátömlesztés határai még ellentmondásosabbak, mint az érett gyermekeknél. Ha a „kék” lámpával és intenzív fototerápiával ellátott fototerápia ellenére a bilirubin továbbra is gyorsan emelkedik és meghaladja a következő terápiás határértéket, akkor a döntést egyedileg kell meghozni.
Gyakorlati tevékenységek
Fototerápia (ha lehetséges, egy „kék” lámpát használjon, amelynek hullámhossza 460 nm):
A gyermek lámpa távolságának a lehető legalacsonyabbnak kell lennie.
Ki kell besugározni a test legnagyobb lehetséges felületét (kis vagy speciális pelenkák!).
Zárt szemek (ragadós csattal ellátott RTM szemvédők megbízható szemvédelem).
3-4 óránként, hogy megváltoztassa a gyermek helyzetét a hasi és hátsó besugárzáshoz (maximum 12 óra). A bilirubin diffundálhat a testfelület nem besugárzott részébe. Ha a test áthelyezése nem lehetséges (például idő előtti), akkor 4 órás fototerápia után 3-4 órás szünet szükséges.
Intenzív fototerápia
Mindkét oldalról „bilirubin szőnyeggel”, például alulról Biliblanket Plus (Ohmeda) sugárzással sugározzuk fel, a lámpa felülről.
Inkubátor (de nem a lámpa) az alumíniumfóliát a környezeti fény tükrözése érdekében csomagolja.
Figyelembe kell venni a fokozott folyadékigényt a korai és újszülöttek intenzív ellátásban, hogy ellenőrizzék az inkubátor állandó hőmérsékletét.
Protein infúzió:
Csak hipoproteinémia esetén (például Biseko).
gondosan: Számos humán albumin-készítmény ellenjavallt, mivel az alkalmazott stabilizátorok vagy az alkohol-frakcionálás megsérti az albuminkötő képességet és az albumin-bilirubin komplex kötődési állandóját.
A Biseko összetétele megfelel az 5% -os albumintartalmú koagulációs faktor nélküli szérumnak, míg nem tartalmaz stabilizálószert.
fenobarbitál:
Nagyon ellentmondásos! Az elhúzódó sárgaságra utalnak Ikterus longatus (hatása legkorábban 3 nap után).
Adag: 5 mg / kg / nap (ha az anya 100 mg / nap adagot kapott a szülés előtt).
Számos év vitatható: a hemoxigenáz (SN-mezoporfirin) és a glükuronizációs enzimek (Fluminicol) blokkolása.
Ha a szülők jöttek:
Állítsa le a fényterápiát, távolítsa el a szemfoltot.
Szoptatás megengedett (2 óránként etetve). Az enterohepatikus recirkuláció csökkentése érdekében a rendszeres széklet hatékonyabb, mint a szájon át adott glükóz adományozás!
Ellenjavallatok a fototerápiához
Az abszolút kontraindikáció a veleszületett eritropoetikus porfiria, vagy a porfiria előzményei a családtagokban. Súlyos fotodermatitisz hólyagosodással és fényérzékenységgel
A fényérzékeny gyógyszerek alkalmazása.
Mellékhatások
Bronz gyermek szindróma a kolesztázisban szenvedő gyermekeknél a fototerápia során
- Sötét szürke-barna színű, ismeretlen eredetű bőr, szérum és vizelet festése.
- Feltehetően: a porfirinek felhalmozódása.
- A fototerápia ellenjavallata azonban nem csökkenti annak hatékonyságát.
Nagyon ritkán a purpura és a bullous bőr változik.
Fokozott folyadékveszteség.
Gyakori laza széklet.
Ellentmondásos: a DNS-helyreállítási mechanizmusok megsértése és a kromoszóma-törékenység növekedése.
A zsírsavak oxidálása a toxikus termékek várható kialakulásával: a zsíremulziók infúziós oldatának lefedésére vagy speciális fényvédő infúziós rendszerek alkalmazására.
A Crigler Naijar szindrómával hosszabb ideig tartó fototerápiával (több éve) barna festés és bőr atrófia lehetséges.