Klór hozzáadása. A természetben lenni
A klórt valószínűleg alkimisták szerezték, de felfedezése és első kutatása elválaszthatatlanul összefügg a híres svéd kémikus, Carl Wilhelm Scheele nevével. Scheele öt kémiai elemet fedezett fel - báriumot és mangánt (Johan Hahnnal együtt), molibdént, volfrámot, klórt, és más vegyészektől függetlenül (bár később) - még hármat: oxigént, hidrogént és nitrogént. Ezt az eredményt a későbbiekben egyetlen vegyész sem tudta megismételni. A Svéd Királyi Tudományos Akadémia tagjává már megválasztott Scheele ugyanakkor egyszerű gyógyszerész volt Köpingben, bár elfoglalhatott volna tiszteletreméltóbb és tekintélyesebb pozíciót is. Maga II. Nagy Frigyes, a porosz király ajánlotta fel neki a kémiaprofesszori posztot a Berlini Egyetemen. Scheele visszautasította az ilyen csábító ajánlatokat: „Nem tudok többet enni, mint amennyire szükségem van, és amit itt Köpingben keresek, az elég enni.”
Számos klórvegyületet ismertek természetesen már jóval Scheele előtt. Ez az elem sok só része, beleértve a leghíresebbet - az asztali sót. 1774-ben Scheele a fekete ásványi piroluzit tömény sósavval való melegítésével szabad formában izolálta a klórt: MnO 2 + 4HCl ® Cl 2 + MnCl 2 + 2H 2 O.
Eleinte a kémikusok a klórt nem elemnek tekintették, hanem az ismeretlen muria elem (a latin muria - sóoldat) oxigénnel alkotott kémiai vegyületeként. Úgy gondolták, hogy a sósav (az úgynevezett morzsasav) kémiailag kötött oxigént tartalmaz. Ezt „tanúsította” különösen a következő tény: amikor egy klóroldat a fényben állt, oxigén szabadult fel belőle, és sósav maradt az oldatban. Az oxigén klórból való „elszakítására” irányuló számos kísérlet azonban nem vezetett sehova. Így senkinek sem sikerült szén-dioxidot előállítani a klór szénnel való hevítésével (ami magas hőmérsékleten „elveszi” az oxigént számos, azt tartalmazó vegyülettől). Humphry Davy, Joseph Louis Gay-Lussac és Louis Jacques Thenard hasonló kísérletei eredményeként világossá vált, hogy a klór nem tartalmaz oxigént, és egyszerű anyag. Ugyanerre a következtetésre jutottak Gay-Lussac kísérletei is, aki a gázok mennyiségi arányát elemezte a klór és a hidrogén reakciójában.
1811-ben Davy a „klór” nevet javasolta az új elemnek - a görögből. "chloros" - sárga-zöld. Pontosan ez a klór színe. Ugyanez a gyök található a „klorofill” szóban (a görög „chloros” és „phyllon” - levél szóból). Egy évvel később Gay-Lussac „klórra” rövidítette a nevet. De a britek (és az amerikaiak) mégis „klórnak” nevezik ezt az elemet, míg a franciák klórnak. A németek, a kémia „törvényhozói” szinte az egész 19. században átvették a rövidített nevet. (németül a klór a Chlor). 1811-ben Johann Schweiger német fizikus a „halogén” nevet javasolta a klór számára (a görög „hals” szóból - só és „gennao” - szülni). Ezt követően ezt a kifejezést nemcsak a klórra, hanem a hetedik csoport összes analógjára is hozzárendelték - fluor, bróm, jód, asztatin.
Érdekes a hidrogén égetésének bemutatása klóratmoszférában: a kísérlet során néha szokatlan mellékhatás lép fel: zümmögő hang hallatszik. Leggyakrabban a láng akkor zúg, amikor egy vékony csövet, amelyen keresztül hidrogént vezetnek, leeresztenek egy klórral teli kúp alakú edénybe; ugyanez igaz a gömblombikra is, de a hengerekben általában nem zúg a láng. Ezt a jelenséget „éneklő lángnak” nevezték.
Vizes oldatban a klór részben és meglehetősen lassan reagál a vízzel; 25°C-on egyensúly: Cl 2 + H 2 O HClO + HCl két napon belül létrejön. A hipoklórsav fény hatására lebomlik: HClO ® HCl + O. Az atomos oxigénnek tulajdonítják a fehérítő hatást (az abszolút száraz klór nem rendelkezik ezzel a képességgel).
A vegyületeiben lévő klór minden oxidációs állapotot mutathat -1-től +7-ig. Oxigénnel a klór számos oxidot képez, tiszta formájában mindegyik instabil és robbanásveszélyes: Cl 2 O - sárga-narancssárga gáz, ClO 2 - sárga gáz (9,7 o C alatt - élénkvörös folyadék), klór-perklorát Cl 2 O 4 (ClO –ClO 3, világossárga folyadék), Cl 2 O 6 (O 2 Cl–O–ClO 3, élénkpiros folyadék), Cl 2 O 7 – színtelen, nagyon robbanásveszélyes folyadék. Alacsony hőmérsékleten instabil Cl 2 O 3 és ClO 3 oxidokat kaptunk. A ClO 2-oxidot ipari méretekben állítják elő, és klór helyett cellulóz fehérítésére, valamint ivóvíz és szennyvíz fertőtlenítésére használják. Más halogénekkel a klór számos úgynevezett interhalogén vegyületet képez, például ClF, ClF 3, ClF 5, BrCl, ICl, ICl 3.
A klór és pozitív oxidációs állapotú vegyületei erős oxidálószerek. 1822-ben Leopold Gmelin német kémikus sárga vérsóból klóros oxidációval vörös sót állított elő: 2K 4 + Cl 2 ® K 3 + 2KCl. A klór könnyen oxidálja a bromidokat és a kloridokat, így szabad formában bróm és jód szabadul fel.
A különböző oxidációs állapotú klór számos savat képez: HCl - sósav (sósav, sók - kloridok), HClO - hipoklór (sók - hipokloritok), HClO 2 - klóros (sók - kloritok), HClO 3 - hipoklór (sók - klorátok) , HClO 4 – klór (sók – perklorátok). Az oxigénsavak közül csak a perklórsav stabil tiszta formájában. Az oxigénsavak sói közül a hipokloritokat a gyakorlatban használják, a nátrium-kloritot NaClO 2 - szövetek fehérítésére, kompakt pirotechnikai oxigénforrások ("oxigéngyertyák"), kálium-klorátok (Bertholometa só), kalcium és magnézium (pl. mezőgazdasági kártevők, mint pirotechnikai kompozíciók és robbanóanyagok komponensei elleni védekezés gyufagyártás során), perklorátok - robbanóanyagok és pirotechnikai készítmények összetevői; Az ammónium-perklorát a szilárd rakéta-üzemanyagok összetevője.
A klór számos szerves vegyülettel reagál. Gyorsan kötődik a kettős és hármas szén-szén kötéssel rendelkező telítetlen vegyületekhez (az acetilénnel való reakció robbanásszerűen megy végbe), fényben pedig a benzolhoz. Bizonyos körülmények között a klór helyettesítheti a hidrogénatomokat a szerves vegyületekben: R–H + Cl 2 ® RCl + HCl. Ez a reakció jelentős szerepet játszott a szerves kémia történetében. Az 1840-es években Jean Baptiste Dumas francia kémikus felfedezte, hogy amikor a klór reagál ecetsavval, a reakció elképesztően könnyen megy végbe.
CH 3 COOH + Cl 2 ® CH 2 ClCOOH + HCl. Feleslegben lévő klór hatására triklór-ecetsav CCl 3 COOH képződik. Sok vegyész azonban bizalmatlan volt Dumas munkájával szemben. Valóban, Berzelius akkoriban általánosan elfogadott elmélete szerint a pozitív töltésű hidrogénatomokat nem lehetett negatív töltésű klóratomokkal helyettesíteni. Ezt a véleményt akkoriban számos kiváló vegyész képviselte, köztük Friedrich Wöhler, Justus Liebig és természetesen maga Berzelius is.
Dumas nevetségessé tételére Wöhler átadott barátjának, Liebignek egy cikket egy bizonyos S. Windler (Schwindler - németül csaló) nevében a Dumas által állítólag felfedezett reakció új sikeres alkalmazásáról. A cikkben Wöhler nyilvánvaló gúnnyal írt arról, hogy a mangán-acetátban Mn(CH 3 COO) 2 hogyan lehetett az összes elemet vegyértéküknek megfelelően klórral helyettesíteni, így sárga kristályos anyag keletkezett, amely csak klórból áll. Azt mondták továbbá, hogy Angliában azáltal, hogy a szerves vegyületekben az összes atomot egymás után klóratomokkal helyettesítik, a közönséges szövetek klórossá alakulnak, és a dolgok ugyanakkor megőrzik kinézetüket. Egy lábjegyzetben az szerepelt, hogy a londoni üzletek élénk kereskedelmet folytatnak kizárólag klórból álló anyagokkal, mivel ez az anyag nagyon jó volt hálósapkákhoz és meleg alsónadrágokhoz.
A klór reakciója szerves vegyületekkel számos szerves klórtermék képződéséhez vezet, köztük a széles körben használt oldószerek: metilén-klorid CH 2 Cl 2, kloroform CHCl 3, szén-tetraklorid CCl 4, triklóretilén CHCl=CCl 2, tetraklóretilén C 2 Cl 4 . Nedvesség jelenlétében a klór elszínezi a növények zöld leveleit és számos színezéket. Ezt még a 18. században használták. szövetek fehérítésére.
A klór mint mérgező gáz.
Scheele, aki klórt kapott, nagyon kellemetlen, erős szagot, légzési nehézséget és köhögést észlelt. Mint utóbb megtudtuk, az ember akkor is érez klórszagot, ha egy liter levegő mindössze 0,005 mg-ot tartalmaz ebből a gázból, ugyanakkor már irritáló hatással van a légutakra, tönkretéve a légúti nyálkahártya sejtjeit. traktus és a tüdő. A 0,012 mg/l koncentráció nehezen tolerálható; ha a klór koncentrációja meghaladja a 0,1 mg/l-t, az életveszélyessé válik: a légzés felgyorsul, görcsössé válik, majd egyre ritkább lesz, 5-25 perc elteltével a légzés leáll. Az ipari vállalkozások levegőjében a megengedett legnagyobb koncentráció 0,001 mg/l, a lakóterületek levegőjében - 0,00003 mg/l.
Tovij Egorovics Lovitz szentpétervári akadémikus, megismételve Scheele 1790-es kísérletét, véletlenül jelentős mennyiségű klórt bocsátott a levegőbe. Belélegzése után elvesztette az eszméletét és elesett, majd nyolc napon át elviselhetetlen mellkasi fájdalmat szenvedett. Szerencsére felépült. A híres angol vegyész, Davy majdnem belehalt a klórmérgezésbe. A kis mennyiségű klórral végzett kísérletek is veszélyesek, mivel súlyos tüdőkárosodást okozhatnak. Azt mondják, hogy Egon Wiberg német vegyész a klórról szóló egyik előadását a következő szavakkal kezdte: „A klór mérgező gáz. Ha a következő demonstráción megmérgeznék, vigyenek ki a friss levegőre. De sajnos az előadást meg kell szakítani.” Ha sok klórt enged a levegőbe, az igazi katasztrófává válik. Ezt tapasztalták az angol-francia csapatok az első világháború alatt. 1915. április 22-én reggel a német parancsnokság úgy döntött, hogy végrehajtja a háborúk történetének első gáztámadását: amikor a szél az ellenség felé fújt, a front egy hat kilométeres kis szakaszán a belga Ypres város közelében. 5730 palack szelepét nyitották ki egyszerre, amelyek mindegyike 30 kg folyékony klórt tartalmazott. 5 percen belül hatalmas sárgászöld felhő képződött, ami lassan távolodott a német lövészárkoktól a szövetségesek felé. Az angol és francia katonák teljesen védtelenek voltak. A gáz a repedéseken át behatolt az összes óvóhelyre, nem volt menekvés onnan: elvégre a gázálarcot még nem találták fel. Ennek eredményeként 15 ezren mérgeztek meg, közülük 5 ezren meghaltak. Egy hónappal később, május 31-én a németek megismételték a gáztámadást a keleti fronton - az orosz csapatok ellen. Ez történt Lengyelországban, Bolimova város közelében. A 12 km-es fronton 12 ezer hengerből 264 tonna klór és sokkal mérgezőbb foszgén (szénsav-klorid COCl 2) keveréke szabadult fel. A cári parancsnokság tudott az Ypresnél történtekről, de az orosz katonáknak nem volt védelmi eszközük! A gáztámadás következtében a veszteség 9146 fő volt, ebből csak 108 puska- és tüzérségi lövedék, a többiek megmérgezést szenvedtek. Ugyanakkor 1183 ember szinte azonnal meghalt.
Hamarosan a kémikusok megmutatták, hogyan lehet megszökni a klórtól: nátrium-tioszulfát oldattal átitatott gézkötésen keresztül kell lélegezni (ezt az anyagot a fotózásban használják, gyakran hiposzulfitnak nevezik). A klór nagyon gyorsan reagál tioszulfát oldattal, oxidálva azt:
Na 2 S 2 O 3 + 4Cl 2 + 5H 2 O ® 2H 2 SO 4 + 2 NaCl + 6 HCl. Természetesen a kénsav sem ártalmatlan anyag, de hígított vizes oldata sokkal kevésbé veszélyes, mint a mérgező klór. Ezért azokban az években a tioszulfátnak másik neve volt - „antiklór”, de az első tioszulfát gázmaszkok nem voltak túl hatékonyak.
1916-ban Nikolai Dmitrievich Zelinsky orosz kémikus és leendő akadémikus feltalált egy valóban hatékony gázmaszkot, amelyben a mérgező anyagokat aktív szénréteg tartja vissza. Az ilyen nagyon fejlett felületű szén lényegesen több klórt tudott visszatartani, mint a hiposzulfittal átitatott géz. Szerencsére a „klórtámadások” csak egy tragikus epizód maradt a történelemben. A világháború után a klórnak már csak békés szakmái maradtak.
Klór használata.
Minden évben hatalmas mennyiségű klór keletkezik világszerte – több tízmillió tonnát. Csak az USA-ban a 20. század végére. Évente mintegy 12 millió tonna klórt állítottak elő elektrolízissel (10. hely a vegyipari termelés között). Ennek nagy részét (legfeljebb 50%-át) szerves vegyületek klórozására fordítják - oldószerek, szintetikus gumi, polivinil-klorid és egyéb műanyagok, kloroprén gumi, növényvédő szerek, gyógyszerek és sok más szükséges és hasznos termék előállítására. A maradékot szervetlen kloridok szintézisére, a cellulóz- és papíriparban fapép fehérítésére, valamint víztisztításra használják fel. A klórt viszonylag kis mennyiségben használják fel a kohászati iparban. Segítségével nagyon tiszta fémeket kapnak - titánt, ónt, tantálot, nióbiumot. A hidrogén klórban való elégetésével hidrogén-kloridot kapnak, és ebből sósavat nyernek. A klórt fehérítőszerek (hipokloritok, fehérítők) előállítására és a víz klórozással történő fertőtlenítésére is használják.
Ilja Leenson
MEGHATÁROZÁS
Klór- a periódusos rendszer tizenhetedik eleme. Megnevezés - Cl a latin „chlorum” szóból. A harmadik periódusban található, VIIA csoport. Nem fémekre utal. A nukleáris töltés 17.
A legfontosabb természetes klórvegyület a nátrium-klorid (étkezési só) NaCl. A nátrium-klorid fő tömege a tengerek és óceánok vizében található. Számos tó vize is jelentős mennyiségű NaCl-t tartalmaz. Szilárd formában is megtalálható, a földkéregben helyenként vastag úgynevezett kősórétegeket képez. Más klórvegyületek is gyakoriak a természetben, például a kálium-klorid a karnallit KCl × MgCl 2 × 6H 2 O és a szilvit KCl formájában.
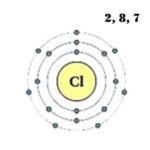
Normál körülmények között a klór sárgászöld gáz (1. ábra), amely vízben jól oldódik. Lehűléskor a vizes oldatokból kristályos hidrátok szabadulnak fel, amelyek hozzávetőlegesen Cl 2 × 6H 2 O és Cl 2 × 8H 2 O összetételű klarátok.
Rizs. 1. Klór folyékony állapotban. Kinézet.
A klór atom- és molekulatömege
Egy elem relatív atomtömege egy adott elem atomjának tömegének a szénatom tömegének 1/12-éhez viszonyított aránya. A relatív atomtömeg dimenzió nélküli, és A r-rel jelöljük (az „r” index az angol relatív szó kezdőbetűje, ami „relatív”). Az atomos klór relatív atomtömege 35,457 amu.
A molekulák tömegét, valamint az atomok tömegét atomtömeg-egységekben fejezzük ki. Egy anyag molekulatömege egy molekula tömege, atomtömeg egységekben kifejezve. Egy anyag relatív molekulatömege egy adott anyag molekulájának tömegének aránya egy szénatom tömegének 1/12-éhez, amelynek tömege 12 amu. Ismeretes, hogy a klór molekula kétatomos - Cl 2. A klórmolekula relatív molekulatömege egyenlő lesz:
M r (Cl 2) = 35,457 × 2 ≈ 71.
A klór izotópjai
Ismeretes, hogy a természetben a klór két stabil izotóp, a 35 Cl (75,78%) és a 37 Cl (24,22%) formájában található. Tömegszámuk 35, illetve 37. A 35 Cl klór izotóp atommagja tizenhét protont és tizennyolc neutront tartalmaz, a 37 Cl izotóp pedig ugyanennyi protont és húsz neutront tartalmaz.
Léteznek mesterséges klór izotópok 35-43 tömegszámmal, amelyek közül a legstabilabb a 36 Cl, felezési ideje 301 ezer év.
Klórionok
A klóratom külső energiaszintje hét elektronból áll, amelyek vegyértékelektronok:
1s 2 2s 2 2p 6 3s 2 3p 5.
A kémiai kölcsönhatás következtében a klór elveszítheti vegyértékelektronjait, i.e. legyen donoruk, és pozitív töltésű ionokká alakuljanak vagy fogadjanak el elektronokat egy másik atomtól, pl. legyen az elfogadójuk, és negatív töltésű ionokká alakuljanak:
Cl 0-7e → Cl 7+;
Cl 0-5e → Cl 5+;
Cl 0-4e → Cl 4+;
Cl 0-3e → Cl 3+;
Cl 0-2e → Cl 2+;
Cl 0-1e → Cl 1+;
Cl 0 +1e → Cl 1-.
Klór molekula és atom
A klórmolekula két atomból áll - Cl 2. Íme néhány tulajdonság, amely a klóratomot és -molekulát jellemzi:
Példák problémamegoldásra
1. PÉLDA
| Gyakorlat | Mekkora térfogatú klórt kell venni ahhoz, hogy 10 liter hidrogénnel reagáljon? A gázok ugyanolyan feltételek mellett vannak. |
| Megoldás | Írjuk fel a klór és a hidrogén reakciójának egyenletét: Cl2+H2=2HCl. Számítsuk ki a reagáló hidrogén mennyiségét: n (H2) = V (H2)/Vm; n (H2) = 10/22,4 = 0,45 mol. Az egyenlet szerint n (H 2) = n (Cl 2) = 0,45 mol. Ekkor a hidrogénnel reagáló klór térfogata egyenlő: |
Figyelembe veszik a klór fizikai tulajdonságait: a klór sűrűségét, hővezető képességét, fajhőjét és dinamikus viszkozitását különböző hőmérsékleteken. A Cl 2 fizikai tulajdonságait táblázatok formájában mutatjuk be a halogén folyékony, szilárd és gáz halmazállapotára vonatkozóan.
A klór alapvető fizikai tulajdonságai
A klór az elemek periódusos rendszerének harmadik periódusának VII. csoportjába tartozik a 17. számmal. A halogének alcsoportjába tartozik, relatív atom- és molekulatömege 35,453, illetve 70,906. -30°C feletti hőmérsékleten a klór zöldessárga gáz, jellegzetes erős, irritáló szaggal. Normál nyomáson (1,013·10 5 Pa) -34°C-ra hűtve könnyen cseppfolyósodik, és átlátszó borostyánsárga folyadékot képez, amely -101°C-on megszilárdul.
Magas kémiai aktivitása miatt a szabad klór nem fordul elő a természetben, csak vegyületek formájában létezik. Főleg a halit ásványban () található, és része olyan ásványoknak is, mint a szilvit (KCl), karnallit (KCl MgCl 2 6H 2 O) és a szilvinit (KCl NaCl). A földkéreg klórtartalma megközelíti a földkéreg összes atomszámának 0,02%-át, ahol két izotóp, 35 Cl és 37 Cl formájában, 75,77% 35 Cl és 24,23% 37 Cl százalékarányban található meg. .
| Ingatlan | Jelentése |
|---|---|
| Olvadáspont, °C | -100,5 |
| Forráspont, °C | -30,04 |
| Kritikus hőmérséklet, °C | 144 |
| Kritikus nyomás, Pa | 77,1 10 5 |
| Kritikus sűrűség, kg/m 3 | 573 |
| Gázsűrűség (0°C-on és 1,013 105 Pa), kg/m 3 | 3,214 |
| Telített gőz sűrűsége (0°C-on és 3,664 10 5 Pa), kg/m 3 | 12,08 |
| Folyékony klór sűrűsége (0°C-on és 3,664 10 5 Pa), kg/m 3 | 1468 |
| Folyékony klór sűrűsége (15,6°C-on és 6,08 10 5 Pa-on), kg/m 3 | 1422 |
| Szilárd klór sűrűsége (-102°C-on), kg/m 3 | 1900 |
| A gáz relatív sűrűsége a levegőben (0°C-on és 1,013 105 Pa-on) | 2,482 |
| Telített gőz relatív sűrűsége levegőben (0°C-on és 3,664 10 5 Pa nyomáson) | 9,337 |
| A folyékony klór relatív sűrűsége 0°C-on (a vízhez viszonyítva 4°C-on) | 1,468 |
| Fajlagos gáztérfogat (0°C-on és 1,013 105 Pa nyomáson), m 3 /kg | 0,3116 |
| Telített gőz fajlagos térfogata (0°C-on és 3,664 10 5 Pa nyomáson), m 3 /kg | 0,0828 |
| Folyékony klór fajlagos térfogata (0°C-on és 3,664 10 5 Pa nyomáson), m 3 /kg | 0,00068 |
| Klór gőznyomás 0°C-on, Pa | 3 664 10 5 |
| A gáz dinamikus viszkozitása 20°C-on, 10 -3 Pa s | 0,013 |
| Folyékony klór dinamikus viszkozitása 20°C-on, 10 -3 Pa s | 0,345 |
| Szilárd klór olvadási hője (olvadásponton), kJ/kg | 90,3 |
| Párolgási hő (forrásponton), kJ/kg | 288 |
| Szublimációs hő (olvadásponton), kJ/mol | 29,16 |
| A gáz moláris hőkapacitása C p (-73…5727°C-on), J/(mol K) | 31,7…40,6 |
| Folyékony klór moláris hőkapacitása C p (-101…-34°C-on), J/(mol K) | 67,1…65,7 |
| Gáz hővezetési együtthatója 0°C-on, W/(m K) | 0,008 |
| A folyékony klór hővezetési együtthatója 30°C-on, W/(m K) | 0,62 |
| Gázentalpia, kJ/kg | 1,377 |
| Telített gőz entalpiája, kJ/kg | 1,306 |
| A folyékony klór entalpiája, kJ/kg | 0,879 |
| Törésmutató 14°C-on | 1,367 |
| Fajlagos elektromos vezetőképesség -70°С-on, S/m | 10 -18 |
| Elektronaffinitás, kJ/mol | 357 |
| Ionizációs energia, kJ/mol | 1260 |
Klór sűrűsége
Normál körülmények között a klór nehéz gáz, amelynek sűrűsége körülbelül 2,5-szer nagyobb. A gáznemű és folyékony klór sűrűsége normál körülmények között (0°C-on) 3,214, illetve 1468 kg/m3. Folyékony vagy gáz halmazállapotú klór hevítésekor sűrűsége csökken a hőtágulás miatti térfogatnövekedés miatt.
A klórgáz sűrűsége
A táblázat a klór sűrűségét gáz halmazállapotban mutatja különböző hőmérsékleteken (-30 és 140°C között) és normál légköri nyomáson (1,013·10 5 Pa). A klór sűrűsége a hőmérséklettel változik – melegítés hatására csökken. Például, 20°C-on a klór sűrűsége 2,985 kg/m3, és ha ennek a gáznak a hőmérséklete 100°C-ra emelkedik, a sűrűség értéke 2,328 kg/m 3 értékre csökken.
| t, °С | ρ, kg/m 3 | t, °С | ρ, kg/m 3 |
|---|---|---|---|
| -30 | 3,722 | 60 | 2,616 |
| -20 | 3,502 | 70 | 2,538 |
| -10 | 3,347 | 80 | 2,464 |
| 0 | 3,214 | 90 | 2,394 |
| 10 | 3,095 | 100 | 2,328 |
| 20 | 2,985 | 110 | 2,266 |
| 30 | 2,884 | 120 | 2,207 |
| 40 | 2,789 | 130 | 2,15 |
| 50 | 2,7 | 140 | 2,097 |
A nyomás növekedésével a klór sűrűsége nő. Az alábbi táblázatok a klórgáz sűrűségét mutatják a -40 és 140°C közötti hőmérséklet-tartományban és a 26,6·10 5 és 213·10 5 Pa közötti nyomástartományban. A nyomás növekedésével arányosan nő a gáz halmazállapotú klór sűrűsége. Például a klórnyomás 53,2 × 10 5 Pa-ról 106,4 × 10 5 Pa-ra történő növekedése 10 °C hőmérsékleten ennek a gáznak a sűrűségének kétszeres növekedéséhez vezet.
| ↓ t, °С | P, kPa → | 26,6 | 53,2 | 79,8 | 101,3 |
|---|---|---|---|---|
| -40 | 0,9819 | 1,996 | — | — |
| -30 | 0,9402 | 1,896 | 2,885 | 3,722 |
| -20 | 0,9024 | 1,815 | 2,743 | 3,502 |
| -10 | 0,8678 | 1,743 | 2,629 | 3,347 |
| 0 | 0,8358 | 1,678 | 2,528 | 3,214 |
| 10 | 0,8061 | 1,618 | 2,435 | 3,095 |
| 20 | 0,7783 | 1,563 | 2,35 | 2,985 |
| 30 | 0,7524 | 1,509 | 2,271 | 2,884 |
| 40 | 0,7282 | 1,46 | 2,197 | 2,789 |
| 50 | 0,7055 | 1,415 | 2,127 | 2,7 |
| 60 | 0,6842 | 1,371 | 2,062 | 2,616 |
| 70 | 0,6641 | 1,331 | 2 | 2,538 |
| 80 | 0,6451 | 1,292 | 1,942 | 2,464 |
| 90 | 0,6272 | 1,256 | 1,888 | 2,394 |
| 100 | 0,6103 | 1,222 | 1,836 | 2,328 |
| 110 | 0,5943 | 1,19 | 1,787 | 2,266 |
| 120 | 0,579 | 1,159 | 1,741 | 2,207 |
| 130 | 0,5646 | 1,13 | 1,697 | 2,15 |
| 140 | 0,5508 | 1,102 | 1,655 | 2,097 |
| ↓ t, °С | P, kPa → | 133 | 160 | 186 | 213 |
|---|---|---|---|---|
| -20 | 4,695 | 5,768 | — | — |
| -10 | 4,446 | 5,389 | 6,366 | 7,389 |
| 0 | 4,255 | 5,138 | 6,036 | 6,954 |
| 10 | 4,092 | 4,933 | 5,783 | 6,645 |
| 20 | 3,945 | 4,751 | 5,565 | 6,385 |
| 30 | 3,809 | 4,585 | 5,367 | 6,154 |
| 40 | 3,682 | 4,431 | 5,184 | 5,942 |
| 50 | 3,563 | 4,287 | 5,014 | 5,745 |
| 60 | 3,452 | 4,151 | 4,855 | 5,561 |
| 70 | 3,347 | 4,025 | 4,705 | 5,388 |
| 80 | 3,248 | 3,905 | 4,564 | 5,225 |
| 90 | 3,156 | 3,793 | 4,432 | 5,073 |
| 100 | 3,068 | 3,687 | 4,307 | 4,929 |
| 110 | 2,985 | 3,587 | 4,189 | 4,793 |
| 120 | 2,907 | 3,492 | 4,078 | 4,665 |
| 130 | 2,832 | 3,397 | 3,972 | 4,543 |
| 140 | 2,761 | 3,319 | 3,87 | 4,426 |
A folyékony klór sűrűsége
A folyékony klór viszonylag szűk hőmérséklet-tartományban létezhet, amelynek határai mínusz 100,5 és plusz 144 ° C között vannak (vagyis az olvadásponttól a kritikus hőmérsékletig). 144°C felett a klór semmilyen nyomás alatt nem válik folyékony halmazállapotúvá. A folyékony klór sűrűsége ebben a hőmérsékleti tartományban 1717 és 573 kg/m3 között változik.
| t, °С | ρ, kg/m 3 | t, °С | ρ, kg/m 3 |
|---|---|---|---|
| -100 | 1717 | 30 | 1377 |
| -90 | 1694 | 40 | 1344 |
| -80 | 1673 | 50 | 1310 |
| -70 | 1646 | 60 | 1275 |
| -60 | 1622 | 70 | 1240 |
| -50 | 1598 | 80 | 1199 |
| -40 | 1574 | 90 | 1156 |
| -30 | 1550 | 100 | 1109 |
| -20 | 1524 | 110 | 1059 |
| -10 | 1496 | 120 | 998 |
| 0 | 1468 | 130 | 920 |
| 10 | 1438 | 140 | 750 |
| 20 | 1408 | 144 | 573 |
A klór fajlagos hőkapacitása
A klórgáz C p fajlagos hőkapacitása kJ/(kg K)-ban 0 és 1200°C közötti hőmérsékleti tartományban és normál légköri nyomáson a következő képlettel számítható ki:
ahol T a klór abszolút hőmérséklete Kelvin-fokban.
Megjegyzendő, hogy normál körülmények között a klór fajlagos hőkapacitása 471 J/(kg K) és melegítés hatására nő. A hőkapacitás növekedése 500°C feletti hőmérsékleten jelentéktelenné válik, és magas hőmérsékleten a klór fajhője gyakorlatilag változatlan marad.
A táblázat a klór fajhőjének a fenti képlet alapján történő kiszámításának eredményeit mutatja (a számítási hiba körülbelül 1%).
| t, °С | C p , J/(kg K) | t, °С | C p , J/(kg K) |
|---|---|---|---|
| 0 | 471 | 250 | 506 |
| 10 | 474 | 300 | 508 |
| 20 | 477 | 350 | 510 |
| 30 | 480 | 400 | 511 |
| 40 | 482 | 450 | 512 |
| 50 | 485 | 500 | 513 |
| 60 | 487 | 550 | 514 |
| 70 | 488 | 600 | 514 |
| 80 | 490 | 650 | 515 |
| 90 | 492 | 700 | 515 |
| 100 | 493 | 750 | 515 |
| 110 | 494 | 800 | 516 |
| 120 | 496 | 850 | 516 |
| 130 | 497 | 900 | 516 |
| 140 | 498 | 950 | 516 |
| 150 | 499 | 1000 | 517 |
| 200 | 503 | 1100 | 517 |
Az abszolút nullához közeli hőmérsékleten a klór szilárd halmazállapotú, és fajlagos hőkapacitása alacsony (19 J/(kg K)). A szilárd Cl 2 hőmérsékletének növekedésével hőkapacitása nő, és mínusz 143°C-on eléri a 720 J/(kg K) értéket.
A folyékony klór fajlagos hőkapacitása 918...949 J/(kg K) 0 és -90 Celsius fok közötti tartományban. A táblázat alapján látható, hogy a folyékony klór fajlagos hőkapacitása nagyobb, mint a gáznemű klóré, és a hőmérséklet emelkedésével csökken.
A klór hővezető képessége
A táblázat a klórgáz hővezetési együtthatóinak értékeit mutatja normál légköri nyomáson -70 és 400°C közötti hőmérsékleti tartományban.
A klór hővezetési együtthatója normál körülmények között 0,0079 W/(m deg), ami 3-szor kisebb, mint azonos hőmérsékleten és nyomáson. A klór felmelegítése a hővezető képességének növekedéséhez vezet. Így 100°C hőmérsékleten a klór e fizikai tulajdonságának értéke 0,0114 W/(m deg) értékre nő.
| t, °С | λ, W/(m fok) | t, °С | λ, W/(m fok) |
|---|---|---|---|
| -70 | 0,0054 | 50 | 0,0096 |
| -60 | 0,0058 | 60 | 0,01 |
| -50 | 0,0062 | 70 | 0,0104 |
| -40 | 0,0065 | 80 | 0,0107 |
| -30 | 0,0068 | 90 | 0,0111 |
| -20 | 0,0072 | 100 | 0,0114 |
| -10 | 0,0076 | 150 | 0,0133 |
| 0 | 0,0079 | 200 | 0,0149 |
| 10 | 0,0082 | 250 | 0,0165 |
| 20 | 0,0086 | 300 | 0,018 |
| 30 | 0,009 | 350 | 0,0195 |
| 40 | 0,0093 | 400 | 0,0207 |
A klór viszkozitása
A klórgáz dinamikus viszkozitásának együtthatója a 20...500°C hőmérséklet-tartományban megközelítőleg kiszámítható a következő képlettel:
ahol η T a klór dinamikus viszkozitásának együtthatója adott hőmérsékleten T, K;
η T 0 - a klór dinamikus viszkozitásának együtthatója T 0 = 273 K hőmérsékleten (normál körülmények között);
C a Sutherland-állandó (klór esetén C = 351).
Normál körülmények között a klór dinamikus viszkozitása 0,0123·10 -3 Pa·s. Melegítéskor a klór fizikai tulajdonsága, például viszkozitása magasabb értékeket vesz fel.
A folyékony klór viszkozitása egy nagyságrenddel nagyobb, mint a gáznemű klóré. Például 20°C hőmérsékleten a folyékony klór dinamikus viszkozitása 0,345·10-3 Pa·s, és a hőmérséklet emelkedésével csökken.
Források:
- Barkov S. A. Halogének és a mangán alcsoport. D. I. Mengyelejev periódusos rendszerének VII. csoportjának elemei. Kézikönyv diákoknak. M.: Nevelés, 1976 - 112 p.
- Fizikai mennyiségek táblázatai. Könyvtár. Szerk. akad. I. K. Kikoina. M.: Atomizdat, 1976 - 1008 p.
- Yakimenko L. M., Pasmanik M. I. Kézikönyv a klór, marónátron és bázikus klórtermékek előállításához. Szerk. 2., per. és mások M.: Kémia, 1976 - 440 p.
A klórt először 1772-ben Scheele szerezte, aki a piroluzit és sósav kölcsönhatása során felszabaduló piroluzitról írt értekezésében leírta: 4HCl + MnO 2 = Cl 2 + MnCl 2 + 2H 2 O
Scheele felfigyelt a klór szagára, amely hasonló az aqua regiához, az arannyal és a cinóberrel való reakcióképességét, valamint fehérítő tulajdonságait. Scheele azonban a kémiában akkoriban domináns flogiszton-elméletnek megfelelően azt javasolta, hogy a klór deflogisztizált sósav, vagyis a sósav oxidja.
Berthollet és Lavoisier azt javasolta, hogy a klór a muria elem oxidja, de az izolálási kísérletek sikertelenek maradtak Davy munkásságáig, akinek sikerült az asztali sót nátriumra és klórra bontani elektrolízissel.
Az elem neve görög eredetű clwroz- "zöld".
A természetben lenni, megkapni:
A természetes klór két izotóp, 35 Cl és 37 Cl keveréke. A földkéregben a klór a leggyakoribb halogén. Mivel a klór nagyon aktív, a természetben csak vegyület formájában fordul elő az ásványokban: halit NaCl, szilvit KCl, szilvinit KCl NaCl, bischofit MgCl 2 6H 2 O, karnallit KCl MgCl 2 6H 2 O, kainit KCl 4 · MgSO 3H 2 O. A legnagyobb klórtartalékot a tengerek és óceánok vizeinek sói tartalmazzák.
Ipari méretekben a klórt nátrium-hidroxiddal és hidrogénnel együtt konyhasóoldat elektrolízisével állítják elő:
2NaCl + 2H 2O => H 2 + Cl 2 + 2NaOH
A szerves vegyületek ipari klórozásának melléktermékeként keletkező hidrogén-kloridból a klór kinyerésére a Deacon-eljárást alkalmazzák (a hidrogén-klorid katalitikus oxidációja légköri oxigénnel):
4HCl + O 2 = 2H 2 O + 2Cl 2
A laboratóriumokban általában alkalmazott eljárások a hidrogén-klorid erős oxidálószerekkel (például mangán(IV)-oxiddal, kálium-permanganáttal, kálium-dikromáttal) történő oxidáción alapulnak:
2KMnO4 + 16HCl = 5Cl2 + 2MnCl2 + 2KCl +8H2O
K 2 Cr 2 O 7 + 14HCl = 3Cl 2 + 2CrCl 3 + 2KCl + 7H 2 O
Fizikai tulajdonságok:
Normál körülmények között a klór sárgászöld gáz, fullasztó szaggal. A klór észrevehetően oldódik vízben ("klórvíz"). 20°C-on 2,3 térfogatrész klór oldódik fel egy térfogat vízben. Forráspont = -34°C; olvadáspont = -101 °C, sűrűség (gáz, n.s.) = 3,214 g/l.
Kémiai tulajdonságok:
A klór nagyon aktív - közvetlenül egyesül a periódusos rendszer szinte minden elemével, fémekkel és nemfémekkel (a szén, nitrogén, oxigén és inert gázok kivételével). A klór nagyon erős oxidálószer, amely hidrogénnel és fémekkel kiszorítja a kevésbé aktív nemfémeket (bróm, jód) a vegyületeikből:
Cl2+2HBr=Br2+2HCl; Cl 2 + 2NaI = I 2 + 2NaCl
Vízben vagy lúgokban oldva a klór dismutálódik, hipoklóros (hevítéskor pedig perklórsavat) és sósavakat, illetve ezek sóit képezve.
Cl 2 + H 2 O HClO + HCl;
A klór számos szerves vegyülettel kölcsönhatásba lép, szubsztitúciós vagy addíciós reakciókba lépve:
CH 3 -CH 3 + xCl 2 => C 2 H 6-x Cl x + xHCl
CH2=CH2+Cl2=>Cl-CH2-CH2-Cl
C 6 H 6 + Cl 2 => C 6 H 6 Cl + HCl
A klórnak hét oxidációs állapota van: -1, 0, +1, +3, +4, +5, +7.
A legfontosabb kapcsolatok:
Hidrogén-klorid HCl- színtelen gáz, amely a levegőben füstölög a vízgőzzel ködcseppek képződése miatt. Szúrós szagú és erősen irritálja a légutakat. Vulkáni gázokban és vizekben, gyomornedvben található. A kémiai tulajdonságok attól függnek, hogy milyen állapotban van (lehet gáz-, folyékony vagy oldatos halmazállapotú). A HCl oldatot ún sósav. Erős sav, és a gyengébb savakat kiszorítja sóikból. sók - kloridok- magas olvadáspontú szilárd kristályos anyagok.
Kovalens kloridok- klórvegyületek nem fémekkel, gázokkal, folyadékokkal vagy olvadó szilárd anyagokkal, amelyek jellegzetes savas tulajdonságokkal rendelkeznek, és általában vízzel könnyen hidrolizálódnak sósavvá:
PCl 5 + 4H 2O = H 3PO 4 + 5HCl;
Klór(I)-oxid Cl 2 O., barnássárga színű, szúrós szagú gáz. Befolyásolja a légzőszerveket. Könnyen oldódik vízben, hipoklórsavat képezve.
Hipoklórsav HClO. Csak megoldásokban létezik. Ez egy gyenge és instabil sav. Könnyen bomlik sósavra és oxigénre. Erős oxidálószer. Akkor keletkezik, amikor a klór feloldódik a vízben. sók - hipokloritok, alacsony stabilitású (NaClO*H 2 O 70 °C-on robbanásszerűen lebomlik), erős oxidálószerek. Széles körben használják fehérítésre és fertőtlenítésre fehérítő por, vegyes só Ca(Cl)OCl
Klórsav HClO 2, szabad formájában instabil, híg vizes oldatban is gyorsan lebomlik. Közepes erősségű sav, sók - kloritokáltalában színtelenek és vízben jól oldódnak. A hipokloritokkal ellentétben a kloritok csak savas környezetben mutatnak kifejezett oxidáló tulajdonságokat. A legnagyobb felhasználás (szövetek és papírpép fehérítésére) a nátrium-klorit NaClO 2.
Klór(IV)-oxid ClO 2, kellemetlen (szúrós) szagú, zöldessárga gáz, ...
Klórsav, HClO 3 - szabad formájában instabil: ClO 2-re és HClO 4 -re aránytalanul. sók - klorátok; Ezek közül a legfontosabbak a nátrium-, kálium-, kalcium- és magnézium-klorátok. Ezek erős oxidálószerek, és redukálószerekkel keverve robbanásveszélyesek. Kálium klorát ( Berthollet só) - KClO 3, a laboratóriumban oxigén előállítására használták, de nagy veszélye miatt már nem használták. A kálium-klorát oldatait gyenge fertőtlenítőként és külső gyógyászati gargalizálásként használták.
Perklórsav HClO 4, vizes oldatokban a perklórsav a legstabilabb az összes oxigéntartalmú klórsav közül. A vízmentes perklórsav, amelyet tömény kénsavból állítanak elő 72%-os HClO 4-ből, nem túl stabil. Ez a legerősebb monoprotikus sav (vizes oldatban). sók - perklorátok oxidálószerként (szilárd hajtóanyagú rakétamotorok) használják.
Alkalmazás:
A klórt számos iparágban, tudományban és háztartási igényekben használják:
- Polivinil-klorid, műanyag keverékek, szintetikus gumi gyártásában;
- Szövet és papír fehérítésére;
- Szerves klórtartalmú rovarölő szerek előállítása - olyan anyagok, amelyek elpusztítják a terményre káros rovarokat, de biztonságosak a növények számára;
- Vízfertőtlenítéshez - „klórozás”;
- Az élelmiszeriparban élelmiszer-adalékanyagként bejegyzett E925;
- Sósav, fehérítő, berthollet só, fémkloridok, mérgek, gyógyszerek, műtrágyák vegyi előállítása során;
- A kohászatban tiszta fémek előállítására: titán, ón, tantál, nióbium.
Biológiai szerep és toxicitás:
A klór az egyik legfontosabb biogén elem, és minden élő szervezet része. Állatokban és emberekben a klórionok részt vesznek az ozmotikus egyensúly fenntartásában, a kloridion optimális sugara a sejtmembránon való áthatoláshoz. A klórionok létfontosságúak a növények számára, részt vesznek a növények energia-anyagcseréjében, aktiválják az oxidatív foszforilációt.
A klór egyszerű anyag formájában mérgező, ha a tüdőbe kerül, a tüdőszövet égési sérüléseit és fulladást okoz. A levegőben körülbelül 0,006 mg/l koncentrációban (azaz a klórszag érzékelési küszöbének kétszerese) irritáló hatással van a légutakra. A klór volt az egyik első vegyi anyag, amelyet Németország használt az első világháborúban.
Korotkova Y., Shvetsova I.
HF Tyumen State University, 571 csoport.
Források: Wikipédia: http://ru.wikipedia.org/wiki/Cl stb.,
Az Orosz Kémiai Műszaki Egyetem honlapja. D. I. Mengyelejev:
A fő alcsoport VII. csoportjába tartozó elemek jellemzői, példaként a klór felhasználásával
Az alcsoport általános jellemzői
1. táblázat: A VIIA alcsoport elemeinek nómenklatúrája
P-elemek, jellemzőek, nemfémek (az asztatin félfém), halogének.
A Hal elem elektrondiagramja (Hal ≠ F):
A VIIA alcsoport elemeit a következő vegyértékek jellemzik:
2. táblázat Valencia
3. A VIIA alcsoport elemeit a következő oxidációs állapotok jellemzik:
3. táblázat Elemek oxidációs állapotai
Egy kémiai elem jellemzői
A klór a VIIA csoport egyik eleme. Sorozatszám 17
Relatív atomtömeg: 35,4527 a. e.m. (g/mol)
 Protonok, neutronok, elektronok száma: 17,18,17
Protonok, neutronok, elektronok száma: 17,18,17
Atomszerkezet:
![]()
Elektronikus képlet:
Tipikus oxidációs állapotok: -1, 0, +1, +3, +4, +5, +7
Ionizációs energia: 1254,9 (13,01) kJ/mol (eV)
Elektronaffinitás: 349 (kJ/mol)
Elektronegativitás Pauling szerint: 3,20
Egy egyszerű anyag jellemzői
Kötés típusa: kovalens, nem poláris
Kétatomos molekula
Izotópok: 35 Cl (75,78%) és 37 Cl (24,22%)
Kristályrács típusa: molekuláris
Termodinamikai paraméterek
4. táblázat
Fizikai tulajdonságok
5. táblázat
Kémiai tulajdonságok
A klór vizes oldata erősen dismutált ("klórvíz")
1. szakasz: Cl 2 + H 2 O = HCl + HOCl
2. szakasz: HOCl = HCl + [O] – atomi oxigén
Az alcsoportban az oxidációs kapacitás fluorról jódra = ˃ csökken
A klór erős oxidálószer:
1. Kölcsönhatás egyszerű anyagokkal
a) hidrogénnel:
Cl2+H2=2HCl
b) fémekkel:
Cl 2 + 2Na = 2NaCl
3Cl 2 + 2Fe = 2FeCl 3
c) néhány kevésbé elektronegatív nemfémmel:
3Cl 2 + 2P = 2PCl 3
Cl 2 + S = SCl 2
Oxigénnel, szénnel és nitrogénnel, klórral közvetlenül nem reagál!
2. Kölcsönhatás összetett anyagokkal
a) vízzel: lásd fent
b) savakkal: nem reagál!
c) lúgos oldatokkal:
hidegben: Cl 2 +2 NaOH = NaCl + NaClO + H 2 O
melegítve: 3Cl 2 + 6 KOH = 5KCl + KClO 3 + 3H 2 O
e) sok szerves anyaggal:
Cl 2 + CH 4 = CH 3 Cl + HCl
C 6 H 6 + Cl 2 = C 6 H 5 Cl + HCl
A legfontosabb klórvegyületek
 Hidrogén-klorid, hidrogén-klorid A (HCl) színtelen, termikusan stabil gáz (normál körülmények között), szúrós szaggal, nedves levegőben füstölög, könnyen oldódik vízben (akár 500 térfogatrész gáz/térfogat víz), így sósav (sósav) keletkezik. –114,22 °C-on a HCl szilárd halmazállapotúvá válik. Szilárd állapotban a hidrogén-klorid két kristálymódosulat formájában létezik: ortorombos, lent stabil és köbös.
Hidrogén-klorid, hidrogén-klorid A (HCl) színtelen, termikusan stabil gáz (normál körülmények között), szúrós szaggal, nedves levegőben füstölög, könnyen oldódik vízben (akár 500 térfogatrész gáz/térfogat víz), így sósav (sósav) keletkezik. –114,22 °C-on a HCl szilárd halmazállapotúvá válik. Szilárd állapotban a hidrogén-klorid két kristálymódosulat formájában létezik: ortorombos, lent stabil és köbös.
A hidrogén-klorid vizes oldatát sósavnak nevezzük. Vízben oldva a következő folyamatok mennek végbe:
HCl g + H 2 O l = H 3 O + l + Cl − l
Az oldódási folyamat erősen exoterm. Vízzel a HCl azeotróp elegyet képez. Ez egy erős monoprotikus sav. Energetikailag kölcsönhatásba lép a hidrogéntől balra lévő feszültségsor összes fémével, bázikus és amfoter oxidokkal, bázisokkal és sókkal, sókat képezve - kloridok:
Mg + 2 HCl → MgCl 2 + H 2
FeO + 2 HCl → FeCl 2 + H 2 O
Erős oxidálószereknek kitéve vagy elektrolízis során a hidrogén-klorid redukáló tulajdonságokat mutat:
MnO 2 + 4 HCl → MnCl 2 + Cl 2 + 2 H 2 O
Melegítéskor a hidrogén-kloridot oxigén oxidálja (katalizátor - réz(II)-klorid CuCl 2):
4 HCl + O 2 → 2 H 2 O +2 Cl 2
A koncentrált sósav azonban reagál a rézzel, és egy vegyértékű rézkomplexet képez:
2 Cu + 4 HCl → 2 H + H 2
3 térfogatrész tömény sósav és 1 térfogatrész tömény salétromsav keverékét „aqua regiának” nevezik. Az Aqua regia még az aranyat és a platinát is képes feloldani. Az aqua regia magas oxidatív aktivitását a benne lévő nitrozil-klorid és klór okozza, amelyek egyensúlyban vannak a kiindulási anyagokkal:
4 H 3 O + + 3 Cl − + NO 3 − = NOCl + Cl 2 + 6 H 2 O
Az oldatban lévő kloridionok nagy koncentrációja miatt a fém kloridkomplexsé kötődik, ami elősegíti annak oldódását:
3 Pt + 4 HNO 3 + 18 HCl → 3 H 2 + 4 NO + 8 H 2 O
A hidrogén-kloridot többszörös kötésekhez való addíciós reakciók is jellemzik (elektrofil addíció):
R-CH=CH2 + HCl → R-CHCl-CH3
R-C≡CH + 2 HCl → R-CCl 2 -CH 3
Klór-oxidok- klór és oxigén szervetlen kémiai vegyületei, amelyek általános képlete: Cl x O y.
A klór a következő oxidokat képezi: Cl 2 O, Cl 2 O 3, ClO 2, Cl 2 O 4, Cl 2 O 6, Cl 2 O 7. Ezen kívül ismertek még: a rövid élettartamú ClO gyök, a ClOO klór-peroxid gyök és a ClO 4 klór-tetroxid gyök.
Az alábbi táblázat a stabil klór-oxidok tulajdonságait mutatja:
6. táblázat
| Ingatlan | Cl2O | ClO2 | ClOClO 3 | Cl 2 O 6 (l)↔2ClO 3 (g) | Cl2O7 |
| Szín és állapot a szobában. hőfok | Sárgásbarna gáz | Sárga-zöld gáz | Világos sárga folyadék | Sötétvörös folyadék | Színtelen folyadék |
| A klór oxidációs állapota | (+1) | (+4) | (+1), (+7) | (+6) | (+7) |
| T. pl., °C | −120,6 | −59 | −117 | 3,5 | −91,5 |
| Forrás hőmérséklete, °C | 2,0 | 44,5 | |||
| d(f, 0 °C), g*cm-3 | - | 1,64 | 1,806 | - | 2,02 |
| ΔH° minta (gáz, 298 K), kJ*mol -1 | 80,3 | 102,6 | ~180 | (155) | |
| ΔG° minta (gáz, 298 K), kJ*mol -1 | 97,9 | 120,6 | - | - | - |
| S° minta (gáz, 298 K), J*K -1 *mol -1 | 265,9 | 256,7 | 327,2 | - | - |
| μ dipólusmomentum, D | 0,78 ± 0,08 | 1,78 ± 0,01 | - | - | 0,72 ± 0,02 |
 klór-oxid (I), Diklór-oxid, hipoklórsavanhidrid - a klór vegyülete +1 oxidációs állapotban oxigénnel.
klór-oxid (I), Diklór-oxid, hipoklórsavanhidrid - a klór vegyülete +1 oxidációs állapotban oxigénnel.
Normál körülmények között barnássárga gáz, jellegzetes szaggal, amely klórra emlékeztet. 2 °C alatti hőmérsékleten a folyadék aranyvörös színű. Mérgező: a légutakat érinti. Spontán lassan lebomlik:
Nagy koncentrációban robbanásveszélyes. Sűrűsége normál körülmények között 3,22 kg/m³. Szén-tetrakloridban oldódik. Vízben oldódik, gyenge hipoklórsavat képez:
Gyorsan reagál lúgokkal:
Cl 2 O + 2NaOH (híg.) = 2NaClO + H 2 O
Klór-dioxid- savas oxid. Vízben oldva klór- és perklórsav képződik (diszproporcionálási reakció). A híg oldatok sötétben stabilak, fényben pedig lassan bomlanak le:
 Klór-dioxid- klór-oxid ( IV), klór és oxigén vegyülete, képlete: ClO 2.
Klór-dioxid- klór-oxid ( IV), klór és oxigén vegyülete, képlete: ClO 2.
Normál körülmények között a ClO 2 jellegzetes szagú, vörösessárga gáz. 10 °C alatti hőmérsékleten a ClO 2 vörösesbarna folyadék. Alacsony stabilitás, fényre, oxidálószerekkel érintkezve és hevítésre felrobban. Vízben jól oldjuk fel. A klór-dioxidot robbanásveszélyessége miatt folyadékként nem lehet tárolni.
Savas oxid. Vízben oldva klór- és perklórsav képződik (diszproporcionálási reakció). A híg oldatok sötétben stabilak, fényben pedig lassan bomlanak le:
A keletkező klórsav nagyon instabil és lebomlik:
Redox tulajdonságokat mutat.
2ClO 2 + 5H 2 SO 4 (hígított) + 10FeSO 4 = 5Fe 2 (SO 4) 3 + 2HCl + 4H 2 O
ClO 2 + 2NaOH hideg. = NaClO 2 + NaClO 3 + H 2 O
ClO 2 + O 3 = ClO 3 + O 2
A ClO 2 számos szerves vegyülettel reagál, és közepes erősségű oxidálószerként működik.
 Hipoklórsav- HClO, egy nagyon gyenge monoprotikus sav, amelyben a klór oxidációs foka +1. Csak megoldásokban létezik.
Hipoklórsav- HClO, egy nagyon gyenge monoprotikus sav, amelyben a klór oxidációs foka +1. Csak megoldásokban létezik.
Vizes oldatokban a hipoklórsav részben protonra és hipoklorit anionra bomlik ClO − :
Instabil. Hipoklórsav és sói - hipokloritok- erős oxidálószerek. Reagál sósavval HCl, molekuláris klórt képezve:
HClO + NaOH (hígítva) = NaClO + H 2 O 
Klórsav- HClO 2, közepes erősségű egybázisú sav.
A klórsav HClO 2 szabad formájában instabil, még híg vizes oldatban is gyorsan lebomlik:
Lúgok semlegesítik.
HClO 2 + NaOH (híg hideg) = NaClO 2 + H 2 O
Ennek a savnak az anhidridje nem ismert.
Sóiból savas oldatot készítenek - kloritok a ClO 2 lúggal való kölcsönhatása eredményeként keletkezik:
Redox tulajdonságokat mutat.
5HClO2 + 3H2SO4 (hígított) + 2KMnO4 = 5HClO3 + 2MnSO4 + K2SO4 + 3H2O
 Klórsav- HClO 3, erős egybázisú sav, amelyben a klór oxidációs foka +5. Nem érkezett meg szabad formában; vizes oldatokban 30% alatti koncentrációban hidegen meglehetősen stabil; töményebb oldatokban lebomlik:
Klórsav- HClO 3, erős egybázisú sav, amelyben a klór oxidációs foka +5. Nem érkezett meg szabad formában; vizes oldatokban 30% alatti koncentrációban hidegen meglehetősen stabil; töményebb oldatokban lebomlik:
A hipoklórsav erős oxidálószer; az oxidációs képesség a koncentráció és a hőmérséklet növekedésével nő. A HClO 3 könnyen redukálható sósavvá:
HClO 3 + 5HCl (tömény) = 3Cl 2 + 3H 2 O
HClO 3 + NaOH (hígítva) = NaClO 3 + H 2 O
Ha SO 2 és levegő keverékét erősen savas oldaton engedjük át, klór-dioxid képződik:
40%-os perklórsavban például a szűrőpapír meggyullad.
8. Természetben lenni:
A földkéregben a klór a leggyakoribb halogén. Mivel a klór nagyon aktív, a természetben csak ásványi anyagok formájában fordul elő.
7. táblázat: Természetbeni lelet
7. táblázat Ásványi formák
A legnagyobb klórtartalékot a tengerek és óceánok vizeinek sói tartalmazzák.
Nyugta
A klór előállításának kémiai módszerei nem hatékonyak és drágák. Ma elsősorban történelmi jelentőséggel bírnak. Előállítható kálium-permanganát sósavval való reagáltatásával:
Scheele módszer
Kezdetben a klór előállítására szolgáló ipari módszer a Scheele-módszeren alapult, vagyis a piroluzit sósavval való reakcióján:
Deacon módszer
Eljárás klór előállítására hidrogén-klorid légköri oxigénnel történő katalitikus oxidációjával.
Elektrokémiai módszerek
Ma a klórt ipari méretekben állítják elő nátrium-hidroxiddal és hidrogénnel együtt konyhasó-oldat elektrolízisével, amelynek fő folyamatait az összefoglaló képlet ábrázolhatja:
Alkalmazás
· Klórtartalmú polimerekből készült ablakprofil
· A fehérítők fő összetevője a Labarraco víz (nátrium-hipoklorit)
· Polivinil-klorid, műanyag keverékek, szintetikus gumi gyártásában.
· Szerves klórok előállítása. A megtermelt klór jelentős részét növényvédő szerek előállítására fordítják. Az egyik legfontosabb rovarirtó szer a hexaklór-ciklohexán (gyakran hexakloránnak nevezik).
· Vegyi harci szerként, valamint egyéb vegyi harci szerek előállításához használják: mustárgáz, foszgén.
· Vízfertőtlenítéshez - „klórozás”.
· Az élelmiszeriparban élelmiszer-adalékanyagként regisztrálva E925.
· Sósav, fehérítő, berthollet só, fémkloridok, mérgek, gyógyszerek, műtrágyák vegyi előállítása során.
· Kohászatban tiszta fémek előállítására: titán, ón, tantál, nióbium.
· Napneutrínók indikátoraként a klór-argon detektorokban.
Számos fejlett ország törekszik a klór mindennapi életben való felhasználásának korlátozására, többek között azért is, mert a klórtartalmú hulladék elégetése során jelentős mennyiségű dioxin keletkezik.