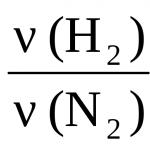Perhitungan kimia menggunakan persamaan kimia. Perhitungan massa suatu zat menggunakan persamaan reaksi kimia
Dengan bantuan koefisien stoikiometri, skema reaksi kimia diubah menjadi persamaannya, yang secara eksplisit mencerminkan hukum kekekalan jumlah atom setiap jenis selama transisi dari zat awal (reagen) ke produk reaksi.
Koefisien stoikiometri memungkinkan kita menetapkan hubungan antara jumlah zat yang berpartisipasi dalam reaksi berdasarkan aturan berikut:
koefisien dalam persamaan kimia tentukangeraham proporsi (rasio) di mana zat awal (reagen) bereaksi dan produk reaksi terbentuk.
Perhatikan, sebagai contoh, reaksi sintesis amonia:
3H 2 + N 2 = 2NH 3,
yang menurut aturan di atas, kita dapat menulis
di mana indeksnya adalah “ex.” dan "arr." sesuai dengan jumlah zat yang bereaksi dan terbentuk. Hubungan terakhir dapat direpresentasikan dalam bentuk lain:
a) untuk zat H 2 dan N 2 : 
atau dalam bentuk lain  ;
;
b) untuk zat H 2 dan NH 3 :  atau
atau  ;
;
c) untuk zat N 2 dan NH 3 :  atau
atau  .
.
Sangat mudah untuk melihat bahwa semua proporsi dapat digabungkan dan ditulis dalam bentuk:
 =
= .
.
Kesetaraan yang terakhir adalah persamaan perhitungan dasar, menghubungkan jumlah zat yang bereaksi dan produk reaksi yang dihasilkan. Jika perlu, massa dan volume peserta reaksi dapat dimasukkan ke dalam persamaan ini dari kondisi masalah menggunakan hubungan biasa.
Misalnya saja untuk reaksinya
4FeS 2 (t) + 11O 2 = 2Fe 2 O 3 (t) + 8SO 2 (g)
persamaan perhitungan utamanya adalah:
dan jika kita memasukkan ke dalamnya massa yang biasanya ditentukan dalam soal padatan, dan volume untuk gas, maka bentuknya akan menjadi sebagai berikut:
Metode kalkulasi menggunakan persamaan desain dasar reaksi kimia mencakup beberapa poin umum:
1) Pertama-tama ditentukan zat pendukungnya, kuantitas dimana semua perhitungan selanjutnya dilakukan. Dalam rumusan masalah, massa, volume, atau konsentrasi ditentukan, yang, pada gilirannya, memungkinkan Anda menghitung jumlah mol zat pendukung. Biasanya, hal ini tidak terlalu sulit, namun pengecualian berlaku pada apa yang disebut masalah kelebihan dan kekurangan, ketika zat pendukung perlu memilih dari dua yang asli. Faktanya adalah bahwa ketika menyiapkan campuran reaksi, zat awal dapat dicampur dalam proporsi berapa pun, tetapi zat tersebut akan selalu bereaksi satu sama lain dalam proporsi yang ditentukan secara ketat, yang menetapkan koefisien stoikiometrinya dalam persamaan reaksi kimia. Dalam kondisi ini, sangat mungkin terjadi ketika salah satu zat awal bereaksi sempurna, tetapi sebagian zat lainnya tetap tidak bereaksi, dan kemudian dikatakan bahwa zat pertama dianggap kekurangan dibandingkan dengan zat kedua dan, sebaliknya, zat kedua. berlebihan jika dibandingkan dengan yang pertama. Dalam hal ini, zat awal yang diambil dalam keadaan kekurangan harus dipilih sebagai zat pendukung, karena kuantitasnya akan menentukan penyelesaian reaksi dan jumlah produk yang terbentuk.
Bagaimana cara menentukan zat pendukung jika soal memuat data (massa, volume, dll) untuk kedua zat awal? Biarkan dua zat A dan B bereaksi
aA + bB → produk reaksi,
dan jumlah awal zat-zat tersebut 0 (A) dan 0 (B) dapat dihitung dari kondisi soal.
Untuk menjawab pertanyaan tersebut, Anda perlu membandingkan dua angka  , di mana tiga opsi dimungkinkan:
, di mana tiga opsi dimungkinkan:
saya var.  , maka campuran reaksi awal disebut stoikiometri dan salah satunya - A atau B - dapat dipilih sebagai zat pendukung;
, maka campuran reaksi awal disebut stoikiometri dan salah satunya - A atau B - dapat dipilih sebagai zat pendukung;
II var.  , maka zat A diambil berlebih dan zat B menjadi penopang;
, maka zat A diambil berlebih dan zat B menjadi penopang;
AKU AKU AKU var.  , maka zat B berlebih dan zat A menjadi penopang.
, maka zat B berlebih dan zat A menjadi penopang.
Akhir dari reaksi kimia ireversibel pada varian pertama terjadi pada saat hilangnya kedua zat awal secara bersamaan, dan pada dua lainnya - pada saat hilangnya zat yang diambil dalam keadaan kekurangan, dan pada campuran akhir zat, bersama dengan produk reaksi, akan ada residu yang tidak bereaksi dari zat yang diambil secara berlebihan.
2) Dari persamaan perhitungan utama berikut sederhana aturan untuk menentukan jumlah mol zat awal yang direaksikan dan produk hasil menurut jumlah mol zat pendukungnya:
Untuk menentukan jumlah mol suatu zat yang bereaksi atau terbentuk dalam suatu reaksi, jumlah mol zat acuan perlu dibagi dengan koefisien stoikiometrinya dan mengalikan hasilnya dengan koefisien stoikiometri zat yang ditentukan.
Untuk reaksi 2Al + 6HCl = 2AlCl 3 + H 2 ,
dimana zat pendukungnya misalnya alumunium, maka dapat dituliskan:



Setelah menentukan jumlah zat yang menarik bagi kita, mudah untuk menghitung massa, volume, dan konsentrasinya, yaitu karakteristik peserta dalam reaksi kimia yang muncul dalam rumusan masalah.
Dengan demikian, skema perhitungan umum persamaan reaksi kimia dapat direpresentasikan sebagai:
Reaksi yang tidak dapat diubah.
Membiarkan  Dan
Dan  jumlah awal reagen A dan B dan
jumlah awal reagen A dan B dan  , yaitu. zat A dikonsumsi secara berlebihan
, yaitu. zat A dikonsumsi secara berlebihan
A SEBUAH+ V B = Dengan C+ D D
|
(kelebihan) |
(kekurangan) | |||||
|
akhir reaksi: |
|
|
|
|||
Reaksi reversibel.
Dalam hal ini, reaksi berakhir dengan terbentuknya kesetimbangan kimia dan campuran kesetimbangan mengandung produk reaksi dan sisa zat awal. Misalkan pada saat keseimbangan tercapai, misalnya, X mol produk C adalah zat pendukung, maka
A SEBUAH+ V B Dengan C+ D D
|
Awal reaksi: |
|
| ||
|
Keseimbangan: |
|
|
|
|
Contoh 1. Suatu larutan yang mengandung 20,0 g natrium hidroksida menyerap 6,72 liter karbon dioksida (n.o.). Tentukan produk reaksi dan jumlahnya.
Ketika larutan alkali menyerap oksida asam (CO 2 , SO 2 , P 2 O 5 , dll.) atau senyawa hidrogen (H 2 S , dll.), yang berhubungan dengan asam polibasa, pada tahap pertama, dengan alkali berlebih , garam sedang selalu terbentuk, yang pada tahap kedua, dengan adanya kelebihan reagen yang diserap, sebagian atau seluruhnya berubah menjadi garam asam:
CO 2 (gas) + 2 NaOH = Na 2 CO 3 + H 2 O
Karbon dioksida yang tersisa bereaksi dengan natrium karbonat:
Na 2 CO 3 + CO 2 (gas) + H 2 O = 2 NaHCO 3
|
akhir reaksi: |
|
|
Jadi larutannya mengandung campuran garam: 0,1 mol NaHCO 3 dan 0,2 mol Na 2 CO 3.
Contoh 2. 6 g natrium hidroksida ditambahkan ke dalam gelas dengan 200 ml larutan asam fosfat dengan konsentrasi molar 0,5 mol/l. Tentukan komposisi larutan setelah reaksi berakhir.
Ketika asam polibasa dinetralkan dengan alkali (NaOH, KOH, NH 3, dll.), atom hidrogen secara berturut-turut digantikan oleh gugus logam atau amonium, dan komposisi produk reaksi bergantung pada rasio jumlah reagen. Dalam kasus kita, jika – NaH 2 PO 4 terbentuk; jika 1:2 maka Na 2 HPO 4 dan jika 1:3 maka Na 3 PO 4. Dalam kasus perantara, terjadi campuran garam.
Mari kita cari jumlah awal reagen: ;  , – terdapat pilihan perantara antara 1:1 dan 1:2, sehingga reaksi terjadi dalam dua tahap:
, – terdapat pilihan perantara antara 1:1 dan 1:2, sehingga reaksi terjadi dalam dua tahap:
H 3 PO 4 + NaOH = NaH 2 PO 4 + H 2 O
NaH 2 PO 4 + NaOH = Na 2 HPO 4 + H 2 O
Jadi, dalam larutan setelah reaksi terdapat campuran garam - masing-masing 0,05 mol NaH 2 PO 4 dan Na 2 HPO 4.
Sukses dalam melaksanakan perhitungan menggunakan rantai persamaan kimia dalam kasus di mana produk dari satu reaksi menjadi bahan awal reaksi lainnya, bergantung pada pilihan urutan transisi yang tepat dari satu persamaan ke persamaan lainnya. Setelah memilih zat pendukung sesuai dengan kondisi soal, akan lebih mudah menggunakan panah untuk menunjukkan urutan penghitungan, mengingat bahwa zat yang diperoleh pada reaksi sebelumnya digunakan dalam jumlah yang sama pada reaksi berikutnya jika, tentu saja, tidak ada kerugian selama seluruh proses multi-tahap dan hasil setiap reaksi adalah 100%.
Contoh 3. Berapa liter klorin dan hidrogen (n.s.) yang diperlukan untuk memperoleh hidrogen klorida yang mampu menetralkan larutan alkali yang terbentuk jika 13,7 g barium dilarutkan dalam air.
Mari kita buat persamaan semua reaksi dan gunakan panah untuk menunjukkan urutan perhitungan:

Zat Pendukung Barium dan Jumlahnya
(Ba) =  .
.
Rantai perhitungan:
persamaan (I) - (Ba(OH) 2 / I) =  =>
=>
persamaan (II) - (HCl / II)=> persamaan (III) –
(Cl 2) =(H 2) =  ,
,
maka V(H 2) = V(Cl 2) = 0,1 mol · 22,4 l/mol = 2,24 l.
Saat memutuskan permasalahan yang melibatkan campuran zat Pertama-tama, setiap komponen campuran perlu mencatat secara terpisah semua reaksi kimia yang dapat diikutinya sesuai dengan kondisi masalahnya. Zat campuran awal biasanya dipilih sebagai zat pendukung dan kuantitasnya (jumlah mol) ditetapkan sebagai tidak diketahui - x, y, z, ...., dan kemudian persamaan keseimbangan bahan dibuat berdasarkan jumlah, massa atau volume (untuk gas) peserta dalam reaksi kimia, di mana dua yang terakhir harus dinyatakan dalam hal yang tidak diketahui. Banyaknya persamaan keseimbangan harus sama dengan jumlah persamaan yang tidak diketahui. Pada tahap terakhir, sistem persamaan aljabar yang dihasilkan diselesaikan.
Contoh 4. Pembakaran 13,44 liter (no.) campuran hidrogen, metana dan karbon monoksida menghasilkan 8,96 liter karbon dioksida dan 14,4 g air. Tentukan jumlah gas dalam campuran.
Persamaan reaksi:
2H 2 + O 2 = 2H 2 O (Saya)
CH 4 + 2O 2 = CO 2 + 2H 2 O (II)
2CO + O 2 = 2CO 2 (III)
Zat pendukung – CH 4, H 2 dan CO; mari kita nyatakan jumlahnya
(H 2) = x; (СH 4) = kamu; ν(BERSAMA) = z.
Mari kita buat tiga persamaan keseimbangan berdasarkan jumlah yang tidak diketahui:
a) keseimbangan volume campuran:
V (H 2) + V(CH 4) + V(CO) = 13,44 l, masukkan yang belum diketahui ke dalamnya:
xV m + yV m + zV m = 13,44 atau x + y + z =  0,6 mol;
0,6 mol;
b) keseimbangan dengan jumlah CO 2:
ν(CO 2 / II) + ν(CO 2 / III) = total. (CO 2), tapi
 ;
;
ν(CO 2 / II) = ν(CH 4) = y; (CO 2 / III) =  z, maka y + z = 0,4.
z, maka y + z = 0,4.
c) saldo jumlah H 2 O:
ν(H 2 O/ I) + ν(H 2 O/ II) = ν total. (H 2 O), tapi
 ,
,
 ;
; ,
,
maka x + 2y = 0,8.
Jadi, kita mendapatkan sistem persamaan bentuk
 ,
,
yang mudah diselesaikan secara lisan
x = 0,2 mol; kamu = 0,3 mol; z = 0,1 mol.
Dalam menyelesaikan masalah komputasi kimia, seseorang harus mampu melakukan perhitungan dengan menggunakan persamaan reaksi kimia. Pelajaran ini dikhususkan untuk mempelajari algoritma untuk menghitung massa (volume, kuantitas) salah satu peserta reaksi dari massa (volume, kuantitas) peserta reaksi lainnya yang diketahui.
Topik: Zat dan transformasinya
Pelajaran:Perhitungan menggunakan persamaan reaksi kimia
Perhatikan persamaan reaksi pembentukan air dari zat sederhana:
2H 2 + O 2 = 2H 2 O
Kita dapat mengatakan bahwa dua molekul air terbentuk dari dua molekul hidrogen dan satu molekul oksigen. Di sisi lain, entri yang sama mengatakan bahwa untuk pembentukan setiap dua mol air, Anda perlu mengambil dua mol hidrogen dan satu mol oksigen.
Rasio molar peserta reaksi membantu membuat perhitungan penting untuk sintesis kimia. Mari kita lihat contoh perhitungan tersebut.
TUGAS 1. Mari kita tentukan massa air yang terbentuk sebagai hasil pembakaran hidrogen dalam 3,2 g oksigen.
Untuk menyelesaikan soal ini, pertama-tama Anda perlu membuat persamaan reaksi kimia dan menuliskan kondisi yang diberikan untuk soal tersebut.
Jika kita mengetahui jumlah oksigen yang bereaksi, kita dapat menentukan jumlah air. Lalu, kita akan menghitung massa air, mengetahui jumlah zat dan. Untuk mencari jumlah oksigen, Anda perlu membagi massa oksigen dengan massa molarnya.
Massa molar secara numerik sama dengan massa relatif. Untuk oksigen, nilainya adalah 32. Mari kita substitusikan ke dalam rumus: jumlah zat oksigen sama dengan perbandingan 3,2 g berbanding 32 g/mol. Ternyata 0,1 mol.
Untuk mencari jumlah zat air, kita tinggalkan proporsinya menggunakan rasio molar peserta reaksi:
Untuk setiap 0,1 mol oksigen terdapat air yang jumlahnya tidak diketahui, dan untuk setiap 1 mol oksigen terdapat 2 mol air.
Jadi jumlah zat air adalah 0,2 mol.
Untuk menentukan massa air, Anda perlu mengalikan nilai jumlah air yang ditemukan dengan massa molarnya, yaitu. kalikan 0,2 mol dengan 18 g/mol, kita mendapatkan 3,6 g air.
Beras. 1. Mencatat kondisi singkat dan solusi Soal 1
Selain massa, Anda dapat menghitung volume gas peserta reaksi (dalam kondisi normal) menggunakan rumus yang Anda ketahui, yang dengannya volume gas pada kondisi normal. sama dengan produk jumlah zat gas dan volume molar. Mari kita lihat contoh penyelesaian suatu masalah.
TUGAS 2. Mari kita hitung volume oksigen (dalam kondisi normal) yang dilepaskan selama penguraian 27 g air.
Mari kita tuliskan persamaan reaksi dan kondisi permasalahan yang diberikan. Untuk mencari volume oksigen yang dilepaskan, pertama-tama Anda harus mencari jumlah zat air melalui massa, kemudian menggunakan persamaan reaksi, menentukan jumlah zat oksigen, setelah itu Anda dapat menghitung volumenya di permukaan tanah.
Jumlah zat air sama dengan perbandingan massa air dengan massa molarnya. Kami mendapatkan nilai 1,5 mol.
Mari kita buat perbandingannya: dari 1,5 mol air terbentuk oksigen yang jumlahnya tidak diketahui, dari 2 mol air terbentuk 1 mol oksigen. Jadi jumlah oksigennya adalah 0,75 mol. Mari kita hitung volume oksigen pada kondisi normal. Ini sama dengan produk jumlah oksigen dan volume molar. Volume molar zat gas pada kondisi sekitar. sama dengan 22,4 l/mol. Mengganti nilai numerik ke dalam rumus, kita memperoleh volume oksigen sebesar 16,8 liter.
Beras. 2. Mencatat kondisi singkat dan solusi Soal 2
Mengetahui algoritma untuk memecahkan masalah tersebut, adalah mungkin untuk menghitung massa, volume atau jumlah zat dari salah satu peserta reaksi dari massa, volume atau jumlah zat dari peserta reaksi lainnya.
1. Kumpulan soal dan latihan kimia: kelas 8: untuk buku teks. P.A. Orzhekovsky dan lainnya “Kimia. kelas 8” / P.A. Orzhekovsky, N.A. Titov, F.F. Hegel. - M.: AST: Astrel, 2006. (hal.40-48)
2. Ushakova O.V. Buku kerja kimia: kelas 8: ke buku teks karya P.A. Orzhekovsky dan lainnya “Kimia. kelas 8” / O.V. Ushakova, P.I. Bespalov, P.A. Orzhekovsky; di bawah. ed. Prof. P.A. Orzhekovsky - M.: AST: Astrel: Profizdat, 2006. (hlm. 73-75)
3. Kimia. kelas 8. Buku pelajaran untuk pendidikan umum institusi / P.A. Orzhekovsky, L.M. Meshcheryakova, M.M. Shalashova. - M.: Astrel, 2013. (§23)
4. Kimia: kelas 8: buku teks. untuk pendidikan umum institusi / P.A. Orzhekovsky, L.M. Meshcheryakova, L.S. Pontak. M.: AST: Astrel, 2005. (§29)
5. Kimia: anorganik. kimia: buku teks. untuk kelas 8 pendidikan umum pembentukan /G.E. Rudzitis, F.G. Feldman. - M.: Pendidikan, OJSC “Moscow Textbooks”, 2009. (hal.45-47)
6. Ensiklopedia untuk anak-anak. Jilid 17. Kimia / Bab. ed.V.A. Volodin, Ved. ilmiah ed. I. Leenson. - M.: Avanta+, 2003.
Sumber daya web tambahan
2. Kumpulan sumber daya pendidikan digital terpadu ().
Pekerjaan rumah
1) hal. 73-75 No.2, 3, 5 dari Buku Kerja Kimia: kelas 8: ke buku teks oleh P.A. Orzhekovsky dan lainnya “Kimia. kelas 8” / O.V. Ushakova, P.I. Bespalov, P.A. Orzhekovsky; di bawah. ed. Prof. P.A. Orzhekovsky - M.: AST: Astrel: Profizdat, 2006.
2) hal.135 No.3,4 dari buku teks P.A. Orzhekovsky, L.M. Meshcheryakova, M.M. Shalashova “Kimia: kelas 8,” 2013
Pelajari algoritme dengan cermat dan tuliskan di buku catatan, selesaikan sendiri masalah yang diajukan
I. Dengan menggunakan algoritme, selesaikan sendiri masalah berikut:
1. Hitung jumlah zat aluminium oksida yang terbentuk dari interaksi aluminium dengan sejumlah zat 0,27 mol dengan jumlah oksigen yang cukup (4 Al +3 HAI 2 =2 Al 2 HAI 3).
2. Hitung jumlah zat natrium oksida yang terbentuk sebagai hasil interaksi natrium dengan zat sebanyak 2,3 mol dengan jumlah oksigen yang cukup (4 Tidak+ HAI 2 =2 Tidak 2 HAI).
Algoritma No.1
Menghitung jumlah suatu zat dari sejumlah zat yang diketahui terlibat dalam suatu reaksi.
Contoh.Hitung jumlah oksigen yang dilepaskan akibat penguraian air dengan jumlah zat 6 mol.
|
Memformat tugas |
|
|
1. Tuliskan kondisi permasalahannya |
Diberikan : ν(H 2 O) = 6 mol _____________ Menemukan : (O 2)=? |
|
Larutan : M(O2)=32g/mol |
|
|
dan tentukan koefisiennya |
2H 2 O=2H 2 +O 2 |
|
, dan di bawah rumus - |
|
|
5. Untuk menghitung jumlah yang dibutuhkan suatu zat, mari kita buat perbandingannya |
|
|
6. Tuliskan jawabannya |
Jawaban: ν (O 2) = 3 mol |
II. Dengan menggunakan algoritme, selesaikan sendiri masalah berikut:
1. Hitung massa belerang yang dibutuhkan untuk memperoleh belerang oksida ( S+ HAI 2 = JADI 2).
2. Hitung massa litium yang diperlukan untuk memperoleh litium klorida dengan jumlah zat 0,6 mol (2 Li+ Kl 2 =2 LiCl).
Algoritma No.2
Menghitung massa suatu zat dari sejumlah zat lain yang diketahui terlibat dalam suatu reaksi.
Contoh:Hitung massa aluminium yang diperlukan untuk memperoleh aluminium oksida dengan jumlah zat 8 mol.
|
Urutan tindakan |
Memformat solusi untuk suatu masalah |
|
1. Tuliskan kondisi permasalahannya |
Diberikan: ν( Al 2 HAI 3 )=8mol ___________ Menemukan: M( Al)=? |
|
2. Hitung massa molar suatu zat, yang dibahas dalam permasalahan tersebut |
M( Al 2 HAI 3 )=102g/mol |
|
3. Mari kita tuliskan persamaan reaksinya dan tentukan koefisiennya |
4 Al + 3O 2 = 2Al 2 O 3 |
|
4. Di atas rumus zat kita tuliskan jumlah zat dari rumusan masalah , dan di bawah rumus - koefisien stoikiometri , ditampilkan oleh persamaan reaksi |
|
|
5. Mari kita hitung jumlah zat yang massanya diperlukan untuk ditemukan. Untuk melakukan ini, mari buat rasio. |
|
|
6. Hitung massa zat yang perlu dicari |
M= ν ∙ M, M(Al)= ν (Al)∙ M(Al)=16mol∙27g/mol=432g |
|
7. Tuliskan jawabannya |
Menjawab: M (Al)= 432 gram |
AKU AKU AKU. Dengan menggunakan algoritme, selesaikan sendiri masalah berikut:
1. Hitung jumlah zat natrium sulfida jika 12,8 g (2 Tidak+ S= Tidak 2 S).
2. Hitung jumlah zat tembaga yang terbentuk jika oksida tembaga bereaksi dengan hidrogen ( II) beratnya 64 gram ( CuO+ H2= Cu+ jam 2 HAI).
Pelajari algoritmanya dengan cermat dan tuliskan di buku catatan Anda.
Algoritma No.3
Menghitung jumlah suatu zat dari massa zat lain yang diketahui terlibat dalam suatu reaksi.
Contoh.Hitung jumlah zat oksida tembaga ( SAYA ), jika tembaga seberat 19,2 g bereaksi dengan oksigen.
|
Urutan tindakan |
Memformat tugas |
|
1. Tuliskan kondisi permasalahannya |
Diberikan: M( Cu)=19,2 gram ___________ Menemukan: ν( Cu 2 HAI)=? |
|
2. Hitung massa molar suatu zat, yang dibahas dalam permasalahan tersebut |
M(Cu)=64g/mol |
|
3. Temukan jumlah zat yang massanya diberikan dalam rumusan masalah |
|
|
dan tentukan koefisiennya |
4 Cu+ HAI 2 =2 Cu 2 HAI |
|
jumlah zat dari rumusan masalah , dan di bawah rumus - koefisien stoikiometri , ditampilkan oleh persamaan reaksi |
|
|
6. Untuk menghitung jumlah yang dibutuhkan suatu zat, mari kita buat perbandingannya |
|
|
7. Tuliskan jawabannya |
Jawaban: ν( Cu 2 HAI )=0,15 mol |
Pelajari algoritmanya dengan cermat dan tuliskan di buku catatan Anda.
IV. Dengan menggunakan algoritme, selesaikan sendiri masalah berikut:
1. Hitung massa oksigen yang diperlukan untuk bereaksi dengan besi seberat 112 g
(3 Fe+4 HAI 2 = Fe 3 HAI 4).
Algoritma No.4
Menghitung massa suatu zat dari massa zat lain yang diketahui ikut serta dalam reaksi
Contoh.Hitung massa oksigen yang diperlukan untuk pembakaran fosfor, seberat 0,31 g.
|
Urutan tindakan |
Memformat tugas |
|
1. Tuliskan kondisi permasalahannya |
Diberikan: M( P)=0,31 gram _________ Menemukan: M( HAI 2 )=? |
|
2. Hitung massa molar suatu zat, yang dibahas dalam permasalahan tersebut |
M(P)=31g/mol M( HAI 2 )=32g/mol |
|
3. Temukan jumlah zat yang massanya diberikan dalam rumusan masalah |
|
|
4. Mari kita tuliskan persamaan reaksinya dan tentukan koefisiennya |
4 P+5 HAI 2 = 2 P 2 HAI 5 |
|
5. Di atas rumus zat kita tuliskan jumlah zat dari rumusan masalah , dan di bawah rumus - koefisien stoikiometri , ditampilkan oleh persamaan reaksi |
|
|
6. Hitung jumlah zat yang massanya perlu dicari M( HAI 2 )= ν ( HAI 2 )∙ M( HAI 2 )= 0,0125mol∙32g/mol=0,4g |
|
|
8. Tuliskan jawabannya |
Menjawab: M ( HAI 2 )=0,4 gram
|
TUGAS UNTUK SOLUSI INDEPENDEN
1. Hitung jumlah zat aluminium oksida yang terbentuk dari interaksi aluminium dengan sejumlah zat 0,27 mol dengan jumlah oksigen yang cukup (4 Al +3 HAI 2 =2 Al 2 HAI 3).
2. Hitung jumlah zat natrium oksida yang terbentuk sebagai hasil interaksi natrium dengan zat sebanyak 2,3 mol dengan jumlah oksigen yang cukup (4 Tidak+ HAI 2 =2 Tidak 2 HAI).
3. Hitung massa belerang yang dibutuhkan untuk memperoleh belerang oksida ( IV) jumlah zat 4 mol ( S+ HAI 2 = JADI 2).
4. Hitung massa litium yang diperlukan untuk memperoleh litium klorida dengan jumlah zat 0,6 mol (2 Li+ Kl 2 =2 LiCl).
5. Hitung jumlah natrium sulfida jika belerang seberat 12,8 g (2 Tidak+ S= Tidak 2 S).
6. Hitung jumlah tembaga yang terbentuk jika oksida tembaga bereaksi dengan hidrogen ( II) beratnya 64 gram ( CuO+ H2=
Ringkasan pelajaran “Perhitungan menggunakan persamaan kimia”
1. Memeriksa pekerjaan rumah
Sebagai pekerjaan rumah, Anda diminta untuk menempatkan koefisien dalam persamaan reaksi.Anda dapat melihat pekerjaan yang dilakukan selama istirahat. Pasti akan ada kesalahan.Apakah semuanya berhasil, apakah ada yang punya pertanyaan?Biarkan mereka berbicara tentang pengalaman rumah mereka.
2. Pengumuman topik dan pemutakhiran ilmu
Topik pelajaran hari ini adalah perhitungan menggunakan persamaan kimia. Pertama, mari kita ingat segala sesuatu yang mungkin berguna bagi kita saat ini. Kita telah menemukan persamaan kimia dalam pekerjaan laboratorium sebelumnya, dalam pekerjaan rumah, dan bahkan sebelumnya dalam topik senyawa biner. Mari kita ingat kembali definisi persamaan reaksi kimia.
(ini adalah notasi konvensional dari reaksi kimia menggunakan rumus dan koefisien kimia.)
Luar biasa.
Saat memproduksi senyawa apa pun, Anda perlu mengetahui berapa banyak bahan awal yang harus diambil untuk mendapatkan massa produk reaksi yang diperlukan. Untuk melakukan ini, buat persamaan reaksi kimia yang sedang berlangsung, dan saat menghitung massa memperhitungkan massa molar zat, dan saat menghitung volume gas memperhitungkan nilainyavolume molar gas
Siapa yang ingat nilai volume molar gas pada kondisi normal? (22,4 l/mol)
Dan apa sajakah kondisi normal tersebut? (tekanan 101,3 kPa dan suhu 0 o C)
Artinya, dalam kondisi ini, 1 mol gas APAPUN menempati volume 22,4 liter.
Sebenarnya untuk menyelesaikan soal, kita perlu mengingat beberapa besaran:
Massa molar – M (g/mol)
Jumlah zat – n (mol)
Volume – V (aku)
Lebih baik begini: Anda ingat bahwa massa molar secara numerik sama dengan massa atom relatif atau massa molekul relatif suatu zat. Untuk melakukan ini, Anda perlu menggunakan tabel periodik, di mana massa atom relatif ditunjukkan di bagian bawah setiap “sel”. Tanpa melupakan aturan pembulatan, kami menggunakan seluruh nilai massa ini dalam perhitungan.
Kimia merupakan ilmu yang sangat jelas, logis dan konsisten, oleh karena itu akan lebih mudah jika menggunakan ALGORITMA yang diberikan dalam buku teks untuk menyelesaikan masalah. Ini adalah rangkaian tindakan universal yang digunakan untuk menyelesaikan masalah apa pun jenis ini.
Silakan buka buku teksnya dan mari kita semua mengenal algoritmanya.
(di sini kita semua membuka buku teks kita bersama-sama, satu orang, mungkin saya, membaca algoritmanya, sisanya mengikuti untuk memahami apa yang harus mereka lakukan sekarang)
Kedengarannya luas, tapi saya harap ini tidak terlalu membingungkan. Mari kita coba mencari tahu dengan sebuah contoh.
Tugas 1. Untuk menghasilkan hidrogen, aluminium dilarutkan dalam asam sulfat: 2Al + 3H 2 JADI 4 → Al 2 (JADI 4 ) 3 + 3H 2 (Poin pertama dari algoritma kami). Untuk reaksinya kami mengambil 10,8 g aluminium. Hitung massa asam sulfat yang dikonsumsi.
Diberikan: m(Al) = 10,8 gram | Larutan: m=10,8 gram m - ? 2Al + 3H 2 JADI 4 → Al 2 (JADI 4 ) 3 + 3H 2 M=27g/mol M=98g/mol Di sini kita dapat menyebutkan bahwa sebenarnya, bukan 2 atom aluminium dan 3 molekul asam yang masuk ke dalam reaksi, tetapi sebagian atom aluminium dan sebagian molekul asam. Bagian ini dalam ilmu kimia disebut dengan kata pendek “mol”. n=2 mol n=3 mol m = M ∙ n m=54 gram m=294 gram Perhitungan berdasarkan proporsi: |
||||
m (H 2 JADI 4 ) - ? |
|||||
10,8 gram | |||||
54 gram | 294 gram | ||||
10,8 gram ∙ 294 gram | |||||
54 gram | |||||
X = 58,8 gram Jawaban: m (H 2 JADI 4 ) = 58,8 gram |
|||||
Itu semua solusi untuk masalah ini. Ada pertanyaan? Mari kita bahas solusinya sekali lagi:
Membuat persamaan
Di atas substansi kita tandatangani apa yang kita KETAHUI dan apa yang INGIN kita TEMUKAN
Berdasarkan rumus kami menuliskan massa molar, jumlah zat danstoikiometri massa zat ( lebih baik menunjukkan "massa menurut tabel periodik")
Membuat proporsi
Memecahkan proporsinya
Merekam jawabannya
Mari kita selesaikan soal serupa, tetapi dengan zat gas (di sini kita tidak akan menggunakan massa molar zat tersebut, tapi apa?...volume molar)
Soal 2. 25 gram seng dilarutkan dalam asam klorida, selama reaksi kimia gas dilepaskan - hidrogen. Hitung volume hidrogen yang dilepaskan.
Diberikan: m(Zn) = 10,8 gram | Larutan: m=25 gram V - ? Zn + 2HCl → ZnCl 2 + H 2 M=65 g/mol V m=22,4 l/mol n=1 mol n=1 mol m=65 gram V=22,4 liter Perhitungan berdasarkan proporsi: |
||||
m(HCl) - ? |
|||||
25 gram | |||||
65 gram | 22,4 liter | ||||
25 gram ∙ 22,4 liter | |||||
65 gram | |||||
X = 8,61 liter Jawaban: V(H 2 ) = 8,61 liter |
|||||
Mari kita periksa bagaimana Anda menguasai materi. Dengan menggunakan algoritma yang sama, selesaikan masalahnya:
BUKAN FAKTA BAHWA ANDA AKAN SUKSES:
Saat bereaksi dengan menggunakan batubara oksida Fe2O3 (pilihan pertama) dan SnO2 (pilihan kedua) masing-masing mendapat 20 g Fe dan Sn. Berapa gram setiap oksida yang diambil?
Harap dicatat bahwa kami sekarang menghitung massa zat awal, bukan produk reaksi)
(biarkan semua orang menyelesaikannya di buku catatan dan secara selektif minta mereka menunjukkan solusinya, kita akan menuliskan persamaannya bersama-sama di papan tulis, dan semua orang akan mencoba menyelesaikannya sendiri)
Fe2O3 + 3C = 2Fe + 3CO m(Fe2O3)= 160*20/2*56= 28,5 gram
SnO2+C=Sn+CO2 m(SnO2)= 20*151/119= 25,38 gram
Pekerjaan rumah: mempelajari materi buku teks hal. 146-150, selesaikan masalahnya
Berapa massa kalsium oksida dan berapa volume karbon dioksida (n.s.)
dapatkah diperoleh dengan menguraikan kalsium karbonat seberat 250 g?HARUS DIBERIKAN KEPADA ANAK SEKOLAHPERSAMAAN SIAPUNTUK MENYELESAIKAN TUGAS INI
Garis besar pelajaran “Perhitungan menggunakan persamaan kimia.”
Buku pelajaran: OS Gabrielyan.
Kelas: 8
Topik pelajaran: Perhitungan menggunakan persamaan kimia.
Jenis pelajaran: digabungkan.
Tujuan pendidikan: memperkenalkan perhitungan menggunakan persamaan kimia; mengembangkan pengetahuan siswa tentang perhitungan menggunakan persamaan kimia; mulai mengembangkan keterampilan dalam menyusun persamaan kimia dan menghitung persamaan.
Tugas pendidikan: melanjutkan pembentukan pandangan dunia ilmu pengetahuan alam, gagasan tentang individu dan keseluruhan.
Tugas perkembangan: terus mengembangkan kemampuan mengamati, menganalisis, menjelaskan, dan menarik kesimpulan.
Metode pengajaran: verbal (penjelasan dan cerita guru), verbal – visual (penjelasan menggunakan catatan di papan tulis).
Peralatan: papan tulis, meja D.I.Mendeleev.
Selama kelas:
1. Momen organisasi (2-5 menit)
Halo teman-teman, silakan duduk. Hari ini dalam pelajaran Anda dan saya harus belajar bagaimana melakukan perhitungan menggunakan persamaan kimia.
2. Uji pengetahuan dan keterampilan (10 – 15 menit)
Pada pelajaran sebelumnya kita telah mempelajari persamaan reaksi kimia, ingatkah kita apa itu persamaan kimia? (Persamaan kimia adalah representasi konvensional dari reaksi kimia menggunakan rumus kimia dan simbol matematika).
Berdasarkan hukum apa reaksi kimia ditulis? (Hukum kekekalan massa zat).
Seperti apa bunyinya? (Massa zat yang mengalami reaksi kimia sama dengan massa zat yang dihasilkannya).
3. Penjelasan materi baru (20 – 30 menit)
Dengan menggunakan persamaan kimia, Anda dapat menentukan zat mana yang bereaksi dan mana yang terbentuk, dan Anda juga dapat menggunakan persamaan kimia untuk menghitung massa, volume, dan jumlah zat yang bereaksi.
Untuk perhitungan, sangat penting untuk memilih satuan massa, volume dan jumlah suatu zat yang bersesuaian satu sama lain. Mari kita buka buku pelajaran di halaman 146 dan temukan tabel nomor 7. Dengan menggunakan tabel ini, mari kita perhatikan perbandingan beberapa satuan besaran fisika dan kimia.
Untuk menyelesaikan masalah perhitungan dalam kimia, Anda dapat menggunakan algoritma. Algoritma penyelesaian masalah diberikan dalam buku teks di halaman 147.
Dengan menggunakan algoritma pemecahan masalah, mari selesaikan masalah berikut:
Tugas: Hitung volume hidrogen (no.) yang diperlukan untuk bereaksi dengan 230 kg besi (III) oksida. Hitung jumlah air yang terbentuk dalam kasus ini.
Diberikan: Solusi:
m(Fe 2 O 3) = 230 kg 1. Tuliskan persamaan reaksi kimianya:
V(H 2) - ?
n(H 2 O) - ? 2. Tuliskan nilai numerik yang diketahui dan tidak diketahui di atas rumus zat dalam persamaan tersebut.
Karena massa dinyatakan dalam kilogram, kita mencari volume dalam meter kubik, dan jumlah zat dalam kilomol. Kemudian:
230kg x m 3 tahun kmol
Fe 2 O 3 + 3H 2 = 2Fe + 3H 2 O
dimana x adalah volume hidrogen V(H 2), y adalah jumlah zat air n(H 2 O).
3. a) Temukan massa 1 kmol Fe 2 O 3 yang ditentukan oleh persamaan kimia dan tuliskan nilai yang dihasilkan berdasarkan rumusnya:
Tuan(Fe 2 O 3) = 56 * 2 + 16 * 3 = 160,
M(Fe 2 O 3) = 160 kg/kmol.
b) Tentukan volume 3 kmol hidrogen V = Vm*n yang ditentukan oleh persamaan, tuliskan nilai yang diperoleh berdasarkan rumus hidrogen: V(3H 2) = 22,4 m 3 /kmol * 3 kmol = 67,2 m 3.
c) Berdasarkan rumus air, kami menunjukkan jumlah yang ditentukan oleh persamaan - 3 kmol.
Persamaannya menjadi
230kg x m 3 tahun kmol
Fe 2 O 3 + 3H 2 = 2Fe + 3H 2 O
160kg 67,2 m 3 3 kmol
4. Mari kita buat dan selesaikan proporsinya:
a) 230 = x, x = 230*67.2 = 201.6 (m3) – volume hidrogen V(H2)
b) 230 = y, y = 230*3 = 9 (kmol) – banyaknya zat air n(H 2 O).
4. Konsolidasi pengetahuan dasar (10 – 12 menit)
Selesaikan masalah (jika memungkinkan, dengan beberapa cara):
Tugas 1. 0,1 mol seng bereaksi dengan oksigen. Berapa banyak oksigen yang dibutuhkan? Berapa banyak seng oksida yang terbentuk?
Tugas 2. Seng bereaksi dengan oksigen dalam jumlah 0,1 mol. Tentukan massa oksigen yang bereaksi, serta massa seng oksida yang terbentuk.
Tugas 3. Aluminium seberat 6,3 g bereaksi dengan oksigen. Tentukan massa oksigen dan oksida besi yang dihasilkan jika aluminium mengandung 20% pengotor.
Tugas 4. Berapa volume hidrogen (n.s.) yang akan dilepaskan ketika 2,7 g asam klorida 25% bereaksi dengan jumlah aluminium yang diperlukan untuk reaksi tersebut? Berapa jumlah zat tersebut?
Tugas 5. Berapa volume karbon dioksida yang akan dilepaskan ketika 60 kg batubara dibakar?
Tugas 6. Berapa mol kalsium oksida yang terbentuk ketika 8 g kalsium yang mengandung 30% pengotor dibakar dalam oksigen?
5. Ringkasan pelajaran (1 -3 menit)
Hari ini di kelas kita sekali lagi teringat menulis persamaan kimia dan belajar bagaimana melakukan perhitungan menggunakan persamaan kimia.
6. Pekerjaan Rumah (1 – 4 menit)
§28, tugas di buku kerja.
Berapa massa besi (III) oksida yang terbentuk ketika 0,6 mol besi dibakar di udara?
Hitung massa aluminium sulfida yang terbentuk ketika 5,4 g bubuk aluminium dilebur dengan belerang. Berapa gram besi (II) sulfida yang terbentuk jika 11,2 g serbuk besi dilebur dengan belerang?
Tentukan massa magnesium yang diperlukan untuk memperoleh 19 g magnesium klorida (misalnya, dengan membakar magnesium dalam klorin).
Berapa liter hidrogen klorida yang terbentuk jika klorin bereaksi dengan 5,5 liter hidrogen?
Berapa volume hidrogen yang dapat bereaksi dengan 150 liter oksigen?
Berapa volume karbon dioksida yang terbentuk ketika 8 liter metana CH 4 dibakar?
Berapa volume karbon dioksida yang dihasilkan ketika 480 g batubara dibakar?
Berapa volume oksigen yang akan dilepaskan jika 100 g air diurai oleh arus listrik?
Berapa volume nitrogen yang terbentuk selama ledakan 1 g nitrogen iodida:
2NJ 3 = N 2 + 3J 2
Berapa gram sulfur oksida (IV) yang terbentuk ketika 12,8 sulfur dibakar?
Berapa massa magnesium oksida yang terbentuk ketika 6 g serutan magnesium dibakar dalam oksigen?
Berapa gram air yang dihasilkan ketika 9 g hidrogen dibakar dalam oksigen?
Berapa gram aluminium yang harus diambil untuk memperoleh 30,6 g aluminium oksida?
Berapa gram litium yang harus dibakar dalam oksigen untuk menghasilkan 15 g litium oksida?
Berapa gram natrium klorida yang terbentuk jika 11,5 g natrium dibakar dalam klor?
Berapa mol besi yang harus diambil untuk memperoleh 32,5 g besi (III) klorida?
Berapa gram aluminium yang diperlukan untuk memperoleh 80,1 g aluminium klorida?
Berapa mol kalsium oksida yang terbentuk ketika 8 g kalsium dibakar dalam oksigen?
Berapa gram aluminium klorida yang dihasilkan jika 10,8 g aluminium foil dibakar dengan klorin?

 tikus tanah
tikus tanah tikus tanah
tikus tanah


 tikus tanah
tikus tanah tikus tanah
tikus tanah