Pridávanie chlóru. Byť v prírode
Chlór pravdepodobne získavali alchymisti, no jeho objavenie a prvé výskumy sú nerozlučne spojené s menom slávneho švédskeho chemika Carla Wilhelma Scheeleho. Scheele objavil päť chemických prvkov - bárium a mangán (spolu s Johanom Hahnom), molybdén, volfrám, chlór a nezávisle od iných chemikov (aj keď neskôr) - ďalšie tri: kyslík, vodík a dusík. Tento úspech už nemohol zopakovať žiadny chemik. V tom istom čase bol Scheele, už zvolený za člena Kráľovskej švédskej akadémie vied, jednoduchým lekárnikom v Köpingu, hoci mohol zaujať čestnejšiu a prestížnejšiu funkciu. Sám Fridrich II. Veľký, pruský kráľ, mu ponúkol miesto profesora chémie na Berlínskej univerzite. Scheele odmietol takéto lákavé ponuky a povedal: „Nemôžem jesť viac, ako potrebujem, a to, čo zarobím tu v Köpingu, mi stačí na jedenie.“
Mnohé zlúčeniny chlóru boli, samozrejme, známe už dávno pred Scheelom. Tento prvok je súčasťou mnohých solí, vrátane tej najznámejšej – kuchynskej soli. V roku 1774 Scheele izoloval chlór vo voľnej forme zahrievaním čierneho minerálu pyrolusitu s koncentrovanou kyselinou chlorovodíkovou: Mn02 + 4HCl® Cl2 + MnCl2 + 2H20.
Chemici najprv považovali chlór nie za prvok, ale za chemickú zlúčeninu neznámeho prvku muria (z lat. muria – soľanka) s kyslíkom. Verilo sa, že kyselina chlorovodíková (nazývala sa kyselina muricová) obsahuje chemicky viazaný kyslík. „Svedčila“ o tom najmä nasledujúca skutočnosť: keď roztok chlóru stál na svetle, uvoľňoval sa z neho kyslík a v roztoku zostala kyselina chlorovodíková. Početné pokusy „vytrhnúť“ kyslík z chlóru však nikam neviedli. Nikto teda nedokázal získať oxid uhličitý zahrievaním chlóru s uhlím (ktoré pri vysokých teplotách „odoberá“ kyslík mnohým zlúčeninám, ktoré ho obsahujú). Výsledkom podobných experimentov, ktoré vykonali Humphry Davy, Joseph Louis Gay-Lussac a Louis Jacques Thenard, sa ukázalo, že chlór neobsahuje kyslík a je to jednoduchá látka. K rovnakému záveru viedli experimenty Gay-Lussaca, ktorý analyzoval kvantitatívny pomer plynov pri reakcii chlóru s vodíkom.
V roku 1811 Davy navrhol názov „chlór“ pre nový prvok – z gréčtiny. "chloros" - žltozelená. Presne taká je farba chlóru. Rovnaký koreň je v slove „chlorofyl“ (z gréckeho „chloros“ a „phyllon“ - list). O rok neskôr Gay-Lussac „skrátil“ názov na „chlór“. Ale Briti (a Američania) stále nazývajú tento prvok „chlór“, zatiaľ čo Francúzi ho nazývajú chlór. Skrátený názov prijali aj Nemci, „zákonodarcovia“ chémie takmer počas celého 19. storočia. (v nemčine je chlór chlór). V roku 1811 navrhol nemecký fyzik Johann Schweiger názov „halogén“ pre chlór (z gréckeho „hals“ – soľ a „gennao“ – rodiť). Následne bol tento termín priradený nielen chlóru, ale aj všetkým jeho analógom v siedmej skupine - fluóru, brómu, jódu, astatínu.
Zaujímavá je demonštrácia spaľovania vodíka v chlórovej atmosfére: niekedy sa počas experimentu vyskytne nezvyčajný vedľajší efekt: zaznie bzučanie. Plameň najčastejšie bzučí, keď sa tenká trubica, cez ktorú sa privádza vodík, spustí do kužeľovej nádoby naplnenej chlórom; to isté platí pre guľové banky, ale vo valcoch plameň zvyčajne nehučí. Tento jav sa nazýval „spievajúci plameň“.
Vo vodnom roztoku chlór čiastočne a dosť pomaly reaguje s vodou; pri 25 °C sa rovnováha: Cl2 + H20 HClO + HCl ustanoví do dvoch dní. Kyselina chlórna sa na svetle rozkladá: HClO ® HCl + O. Práve atómovému kyslíku sa pripisuje bieliaci účinok (absolútne suchý chlór túto schopnosť nemá).
Chlór vo svojich zlúčeninách môže vykazovať všetky oxidačné stavy – od –1 do +7. S kyslíkom tvorí chlór množstvo oxidov, všetky v čistej forme sú nestabilné a výbušné: Cl 2 O - žltooranžový plyn, ClO 2 - žltý plyn (pod 9,7 o C - jasnočervená kvapalina), chloristan Cl 2 O 4 (ClO –ClO 3, svetložltá kvapalina), Cl 2 O 6 (O 2 Cl–O–ClO 3, svetločervená kvapalina), Cl 2 O 7 – bezfarebná, veľmi výbušná kvapalina. Pri nízkych teplotách sa získali nestabilné oxidy Cl 2 O 3 a ClO 3. Oxid ClO 2 sa vyrába v priemyselnom meradle a používa sa namiesto chlóru na bielenie buničiny a dezinfekciu pitnej a odpadovej vody. S inými halogénmi tvorí chlór množstvo takzvaných interhalogénových zlúčenín, napríklad ClF, ClF 3, ClF 5, BrCl, ICl, ICl 3.
Chlór a jeho zlúčeniny s kladným oxidačným stavom sú silné oxidačné činidlá. Nemecký chemik Leopold Gmelin získal v roku 1822 zo žltej krvnej soli oxidáciou chlórom červenú soľ: 2K 4 + Cl 2 ® K 3 + 2KCl. Chlór ľahko oxiduje bromidy a chloridy, pričom uvoľňuje bróm a jód vo voľnej forme.
Chlór v rôznych oxidačných stupňoch tvorí množstvo kyselín: HCl - chlorovodíková (chlorovodíková, soli - chloridy), HClO - chlórna (soli - chlornany), HClO 2 - chlórna (soli - chloritany), HClO 3 - chlórna (soli - chlorečnany) , HClO 4 – chlór (soli – chloristany). Z kyslíkatých kyselín je stabilná len kyselina chloristá v čistej forme. Zo solí kyslíkatých kyselín sa v praxi používajú chlórnany, chloritan sodný NaClO 2 - na bielenie tkanín, na výrobu kompaktných pyrotechnických zdrojov kyslíka („kyslíkové sviečky“), chlorečnany draselné (soľ Bertolometa), vápnik a horčík (napr. ničenie poľnohospodárskych škodcov, ako zložky pyrotechnických zloží a výbušnín, pri výrobe zápaliek), chloristany - zložky výbušnín a pyrotechnických zloží; Chloristan amónny je súčasťou pevných raketových palív.
Chlór reaguje s mnohými organickými zlúčeninami. Rýchlo sa viaže na nenasýtené zlúčeniny s dvojitými a trojitými väzbami uhlík-uhlík (reakcia s acetylénom prebieha explozívne) a na svetle na benzén. Za určitých podmienok môže chlór nahradiť atómy vodíka v organických zlúčeninách: R–H + Cl 2 ® RCl + HCl. Táto reakcia zohrala významnú úlohu v histórii organickej chémie. V štyridsiatych rokoch 19. storočia francúzsky chemik Jean Baptiste Dumas objavil, že keď chlór reaguje s kyselinou octovou, reakcia prebieha s úžasnou ľahkosťou.
CH3COOH + Cl2® CH2CICOOH + HCl. Pri prebytku chlóru vzniká kyselina trichlóroctová CCl 3 COOH. Mnohí chemici však boli k Dumasovej práci nedôverčiví. Podľa vtedy všeobecne akceptovanej teórie Berzeliusa totiž nemohli byť kladne nabité atómy vodíka nahradené záporne nabitými atómami chlóru. Tento názor v tom čase zastávali mnohí vynikajúci chemici, medzi ktorými boli Friedrich Wöhler, Justus Liebig a samozrejme aj samotný Berzelius.
Na posmech Dumasa odovzdal Wöhler svojmu priateľovi Liebigovi v mene istého S. Windlera (Schwindler - po nemecky podvodník) článok o novej úspešnej aplikácii reakcie, ktorú údajne objavil Dumas. Wöhler v článku so zjavným výsmechom písal o tom, ako v octane mangánu Mn(CH 3 COO) 2 bolo možné nahradiť všetky prvky podľa ich mocenstva chlórom, čím vznikla žltá kryštalická látka pozostávajúca len z chlóru. Ďalej sa hovorilo, že v Anglicku postupným nahrádzaním všetkých atómov v organických zlúčeninách atómami chlóru sa obyčajné látky premieňajú na chlórové a veci si zároveň zachovávajú svoj vzhľad. V poznámke pod čiarou bolo uvedené, že londýnske obchody predávali čilý obchod s materiálom pozostávajúcim iba zo samotného chlóru, pretože tento materiál bol veľmi dobrý na nočné čiapky a teplé spodky.
Reakcia chlóru s organickými zlúčeninami vedie k vzniku mnohých organochlórových produktov, medzi ktoré patria široko používané rozpúšťadlá metylénchlorid CH 2 Cl 2, chloroform CHCl 3, tetrachlórmetán CCl 4, trichlóretylén CHCl=CCl 2, tetrachlóretylén C 2 Cl 4 . V prítomnosti vlhkosti chlór odfarbuje zelené listy rastlín a mnohé farbivá. Toto sa používalo už v 18. storočí. na bielenie tkanín.
Chlór ako jedovatý plyn.
Scheele, ktorý dostal chlór, zaznamenal veľmi nepríjemný silný zápach, ťažkosti s dýchaním a kašľom. Ako sme neskôr zistili, človek cíti chlór aj keď jeden liter vzduchu obsahuje len 0,005 mg tohto plynu a zároveň už pôsobí dráždivo na dýchacie cesty, ničí bunky sliznice dýchacích ciest. traktu a pľúc. Koncentrácia 0,012 mg/l je ťažko tolerovateľná; ak koncentrácia chlóru prekročí 0,1 mg/l, stáva sa život ohrozujúcim: dýchanie sa zrýchľuje, stáva sa kŕčovitým a potom sa stáva čoraz zriedkavejším a po 5–25 minútach sa dýchanie zastaví. Maximálna prípustná koncentrácia v ovzduší priemyselných podnikov je 0,001 mg/l a vo vzduchu obytných oblastí - 0,00003 mg/l.
Petrohradský akademik Tovij Egorovič Lovitz pri opakovaní Scheeleho experimentu v roku 1790 náhodne vypustil do ovzdušia značné množstvo chlóru. Po vdýchnutí stratil vedomie a spadol, potom osem dní trpel neznesiteľnou bolesťou na hrudníku. Našťastie sa uzdravil. Slávny anglický chemik Davy takmer zomrel na otravu chlórom. Experimenty aj s malým množstvom chlóru sú nebezpečné, pretože môžu spôsobiť vážne poškodenie pľúc. Hovorí sa, že nemecký chemik Egon Wiberg začal jednu zo svojich prednášok o chlóre slovami: „Chlór je jedovatý plyn. Ak sa pri najbližšej demonštrácii otrávim, zoberte ma prosím na čerstvý vzduch. Ale, bohužiaľ, prednáška bude musieť byť prerušená.“ Ak vypustíte do ovzdušia veľa chlóru, stane sa z toho skutočná katastrofa. To zažili anglo-francúzske vojská počas prvej svetovej vojny. Ráno 22. apríla 1915 sa nemecké velenie rozhodlo uskutočniť prvý plynový útok v dejinách vojen: keď vietor zafúkal smerom k nepriateľovi, na malom šesťkilometrovom úseku frontu pri belgickom meste Ypres. Súčasne sa otvorili ventily 5 730 valcov, z ktorých každý obsahoval 30 kg kvapalného chlóru. Do 5 minút sa vytvoril obrovský žltozelený mrak, ktorý sa pomaly vzďaľoval od nemeckých zákopov smerom k spojencom. Anglickí a francúzski vojaci boli úplne bezbranní. Plyn prenikol cez trhliny do všetkých úkrytov, nebolo z neho úniku: plynová maska napokon ešte nebola vynájdená. V dôsledku toho bolo otrávených 15 tisíc ľudí, z toho 5 tisíc na smrť. O mesiac neskôr, 31. mája, Nemci zopakovali plynový útok na východnom fronte – proti ruským jednotkám. Stalo sa tak v Poľsku pri meste Bolimova. Na 12 km fronte sa z 12-tisíc valcov uvoľnilo 264 ton zmesi chlóru a oveľa toxickejšieho fosgénu (chlorid uhličitý COCl 2). Cárske velenie vedelo o tom, čo sa stalo v Ypres, a napriek tomu ruskí vojaci nemali prostriedky na obranu! V dôsledku plynového útoku dosiahli straty 9 146 ľudí, z toho len 108 v dôsledku puškového a delostreleckého ostreľovania, zvyšok bol otrávený. Zároveň takmer okamžite zomrelo 1 183 ľudí.
Čoskoro chemici ukázali, ako uniknúť z chlóru: musíte dýchať cez gázový obväz namočený v roztoku tiosíranu sodného (táto látka sa používa vo fotografii, často sa nazýva hyposulfit). Chlór veľmi rýchlo reaguje s roztokom tiosíranu a oxiduje ho:
Na2S203 + 4Cl2 + 5H20® 2H2S04 + 2NaCl + 6HCl. Samozrejme, kyselina sírová tiež nie je neškodná látka, ale jej zriedený vodný roztok je oveľa menej nebezpečný ako jedovatý chlór. Preto v tých rokoch mal tiosíran iný názov - „antichlór“, ale prvé tiosíranové plynové masky neboli príliš účinné.
V roku 1916 ruský chemik a budúci akademik Nikolaj Dmitrievič Zelinskij vynašiel skutočne účinnú plynovú masku, v ktorej sa toxické látky zadržiavali vrstvou aktívneho uhlia. Takéto uhlie s veľmi vyvinutým povrchom by mohlo zadržať podstatne viac chlóru ako gáza nasiaknutá hyposiričitanom. Našťastie „chlórové útoky“ zostali iba tragickou epizódou v histórii. Po svetovej vojne ostali chlóru len mierumilovné profesie.
Použitie chlóru.
Každý rok sa na celom svete vyprodukuje obrovské množstvo chlóru – desiatky miliónov ton. Len v USA do konca 20. storočia. Ročne sa elektrolýzou vyprodukovalo asi 12 miliónov ton chlóru (10. miesto medzi chemickou výrobou). Prevažná časť (až 50%) sa vynakladá na chloráciu organických zlúčenín - na výrobu rozpúšťadiel, syntetického kaučuku, polyvinylchloridu a iných plastov, chloroprénového kaučuku, pesticídov, liekov a mnohých ďalších potrebných a užitočných produktov. Zvyšok sa spotrebuje na syntézu anorganických chloridov, v celulózovom a papierenskom priemysle na bielenie drevnej buničiny a na čistenie vody. V hutníckom priemysle sa chlór používa v relatívne malých množstvách. S jeho pomocou sa získavajú veľmi čisté kovy - titán, cín, tantal, niób. Spaľovaním vodíka v chlóre sa získava chlorovodík a z neho kyselina chlorovodíková. Chlór sa používa aj na výrobu bieliacich prostriedkov (chlórnany, bielidlá) a dezinfekciu vody chlórovaním.
Iľja Leenson
DEFINÍCIA
Chlór- sedemnásty prvok periodickej tabuľky. Označenie - Cl z latinského "chlorum". Nachádza sa v tretej tretine skupiny VIIA. Vzťahuje sa na nekovy. Jadrový náboj je 17.
Najdôležitejšou prírodnou zlúčeninou chlóru je chlorid sodný (kuchynská soľ) NaCl. Hlavná hmotnosť chloridu sodného sa nachádza vo vode morí a oceánov. Vody mnohých jazier tiež obsahujú značné množstvo NaCl. Vyskytuje sa aj v pevnej forme, pričom v zemskej kôre miestami vytvára hrubé vrstvy takzvanej kamennej soli. V prírode sú bežné aj iné zlúčeniny chlóru, napríklad chlorid draselný vo forme minerálov karnallit KCl × MgCl 2 × 6H 2 O a sylvit KCl.
Za normálnych podmienok je chlór žltozelený plyn (obr. 1), ktorý je vysoko rozpustný vo vode. Po ochladení sa z vodných roztokov uvoľňujú kryštalické hydráty, ktoré sú klaráty s približným zložením Cl 2 × 6H 2 O a Cl 2 × 8H 2 O.
Ryža. 1. Chlór v kvapalnom stave. Vzhľad.
Atómová a molekulová hmotnosť chlóru
Relatívna atómová hmotnosť prvku je pomer hmotnosti atómu daného prvku k 1/12 hmotnosti atómu uhlíka. Relatívna atómová hmotnosť je bezrozmerná a označuje sa A r (index „r“ je začiatočné písmeno anglického slova relativní, čo znamená „relatívny“). Relatívna atómová hmotnosť atómového chlóru je 35,457 amu.
Hmotnosti molekúl, ako aj hmotnosti atómov, sú vyjadrené v atómových hmotnostných jednotkách. Molekulová hmotnosť látky je hmotnosť molekuly vyjadrená v atómových hmotnostných jednotkách. Relatívna molekulová hmotnosť látky je pomer hmotnosti molekuly danej látky k 1/12 hmotnosti atómu uhlíka, ktorého hmotnosť je 12 amu. Je známe, že molekula chlóru je dvojatómová - Cl2. Relatívna molekulová hmotnosť molekuly chlóru sa bude rovnať:
Mr (Cl2) = 35,457 x 2 = 71.
Izotopy chlóru
Je známe, že v prírode sa chlór nachádza vo forme dvoch stabilných izotopov 35 Cl (75,78 %) a 37 Cl (24,22 %). Ich hmotnostné čísla sú 35 a 37. Jadro atómu izotopu chlóru 35 Cl obsahuje sedemnásť protónov a osemnásť neutrónov a izotop 37 Cl obsahuje rovnaký počet protónov a dvadsať neutrónov.
Existujú umelé izotopy chlóru s hmotnostnými číslami od 35 do 43, z ktorých najstabilnejší je 36 Cl s polčasom rozpadu 301 tisíc rokov.
Ióny chlóru
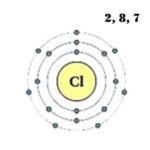
Vonkajšia energetická hladina atómu chlóru má sedem elektrónov, ktoré sú valenčnými elektrónmi:
1s 2 2s 2 2p 6 3s 2 3p 5 .
V dôsledku chemickej interakcie môže chlór stratiť svoje valenčné elektróny, t.j. byť ich donorom, a premeniť sa na kladne nabité ióny alebo prijať elektróny z iného atómu, t.j. byť ich akceptorom a premeniť sa na záporne nabité ióny:
Cl0-7e -> Cl7+;
Cl0-5e -> Cl5+;
Cl0-4e -> Cl4+;
Cl0-3e -> Cl3+;
Cl0-2e -> Cl2+;
Cl0-1e -> Cl1+;
Cl0+1e -> Cl1-.
Molekula a atóm chlóru
Molekula chlóru pozostáva z dvoch atómov - Cl2. Tu sú niektoré vlastnosti charakterizujúce atóm a molekulu chlóru:
Príklady riešenia problémov
PRÍKLAD 1
| Cvičenie | Aký objem chlóru treba odobrať, aby reagoval s 10 litrami vodíka? Plyny sú za rovnakých podmienok. |
| Riešenie | Napíšme rovnicu pre reakciu medzi chlórom a vodíkom: Cl2 + H2 = 2 HCl. Vypočítajme množstvo vodíkovej látky, ktorá reagovala: n(H2) = V(H2)/Vm; n (H2) = 10/22,4 = 0,45 mol. Podľa rovnice n (H 2) = n (Cl 2) = 0,45 mol. Potom sa objem chlóru, ktorý reagoval s vodíkom, rovná: |
Zohľadňujú sa fyzikálne vlastnosti chlóru: hustota chlóru, jeho tepelná vodivosť, špecifické teplo a dynamická viskozita pri rôznych teplotách. Fyzikálne vlastnosti Cl2 sú uvedené vo forme tabuliek pre kvapalné, pevné a plynné skupenstvo tohto halogénu.
Základné fyzikálne vlastnosti chlóru
Chlór je zaradený do skupiny VII tretej periódy periodickej tabuľky prvkov pod číslom 17. Patrí do podskupiny halogénov, má relatívne atómové a molekulové hmotnosti 35,453 a 70,906. Pri teplotách nad -30°C je chlór zelenožltý plyn s charakteristickým silným, dráždivým zápachom. Pri normálnom tlaku (1,013·10 5 Pa) pri ochladení na -34 °C ľahko skvapalňuje a vytvára číru jantárovú kvapalinu, ktorá tuhne pri -101 °C.
Pre svoju vysokú chemickú aktivitu sa voľný chlór v prírode nevyskytuje, ale existuje len vo forme zlúčenín. Nachádza sa hlavne v minerále halite () a je tiež súčasťou takých minerálov, ako je sylvit (KCl), karnallit (KCl MgCl 2 6H 2 O) a sylvinit (KCl NaCl). Obsah chlóru v zemskej kôre sa blíži k 0,02 % z celkového počtu atómov zemskej kôry, kde sa nachádza vo forme dvoch izotopov 35 Cl a 37 Cl v percentuálnom pomere 75,77 % 35 Cl a 24,23 % 37 Cl. .
| Nehnuteľnosť | Význam |
|---|---|
| Teplota topenia, °C | -100,5 |
| Teplota varu, °C | -30,04 |
| Kritická teplota, °C | 144 |
| Kritický tlak, Pa | 77,1 10 5 |
| Kritická hustota, kg/m3 | 573 |
| Hustota plynu (pri 0 °C a 1,013 10 5 Pa), kg/m 3 | 3,214 |
| Hustota nasýtenej pary (pri 0 °C a 3,664 10 5 Pa), kg/m 3 | 12,08 |
| Hustota kvapalného chlóru (pri 0 °C a 3,664 10 5 Pa), kg/m 3 | 1468 |
| Hustota kvapalného chlóru (pri 15,6 °C a 6,08 10 5 Pa), kg/m 3 | 1422 |
| Hustota pevného chlóru (pri -102°C), kg/m3 | 1900 |
| Relatívna hustota plynu vo vzduchu (pri 0 °C a 1,013 10 5 Pa) | 2,482 |
| Relatívna hustota nasýtenej pary vo vzduchu (pri 0 °C a 3,664 10 5 Pa) | 9,337 |
| Relatívna hustota kvapalného chlóru pri 0 °C (vo vzťahu k vode pri 4 °C) | 1,468 |
| Špecifický objem plynu (pri 0 °C a 1,013 10 5 Pa), m 3 /kg | 0,3116 |
| Špecifický objem nasýtenej pary (pri 0°C a 3,664 10 5 Pa), m 3 /kg | 0,0828 |
| Špecifický objem kvapalného chlóru (pri 0 °C a 3,664 10 5 Pa), m 3 /kg | 0,00068 |
| Tlak pár chlóru pri 0 °C, Pa | 3,664 10 5 |
| Dynamická viskozita plynu pri 20°C, 10 -3 Pa s | 0,013 |
| Dynamická viskozita kvapalného chlóru pri 20°C, 10 -3 Pa s | 0,345 |
| Teplo topenia pevného chlóru (pri teplote topenia), kJ/kg | 90,3 |
| Výparné teplo (pri bode varu), kJ/kg | 288 |
| Sublimačné teplo (pri teplote topenia), kJ/mol | 29,16 |
| Molárna tepelná kapacita C p plynu (pri -73…5727°C), J/(mol K) | 31,7…40,6 |
| Molárna tepelná kapacita Cp kvapalného chlóru (pri -101…-34°C), J/(mol K) | 67,1…65,7 |
| Súčiniteľ tepelnej vodivosti plynu pri 0°C, W/(m K) | 0,008 |
| Súčiniteľ tepelnej vodivosti kvapalného chlóru pri 30°C, W/(m K) | 0,62 |
| Entalpia plynu, kJ/kg | 1,377 |
| Entalpia nasýtenej pary, kJ/kg | 1,306 |
| Entalpia kvapalného chlóru, kJ/kg | 0,879 |
| Index lomu pri 14°C | 1,367 |
| Špecifická elektrická vodivosť pri -70°С, S/m | 10 -18 |
| Elektrónová afinita, kJ/mol | 357 |
| Ionizačná energia, kJ/mol | 1260 |
Hustota chlóru
Za normálnych podmienok je chlór ťažký plyn s hustotou približne 2,5-krát vyššou. Hustota plynného a kvapalného chlóru za normálnych podmienok (pri 0°C) sa rovná 3,214 a 1468 kg/m3, resp.. Pri zahrievaní kvapalného alebo plynného chlóru sa jeho hustota znižuje v dôsledku zväčšenia objemu v dôsledku tepelnej rozťažnosti.
Hustota plynného chlóru
V tabuľke je uvedená hustota chlóru v plynnom stave pri rôznych teplotách (v rozmedzí -30 až 140°C) a normálnom atmosférickom tlaku (1,013·10 5 Pa). Hustota chlóru sa mení s teplotou – pri zahriatí klesá. Napríklad, pri 20°C je hustota chlóru 2,985 kg/m3 a keď sa teplota tohto plynu zvýši na 100 °C, hodnota hustoty sa zníži na hodnotu 2,328 kg/m3.
| t, °С | ρ, kg/m3 | t, °С | ρ, kg/m3 |
|---|---|---|---|
| -30 | 3,722 | 60 | 2,616 |
| -20 | 3,502 | 70 | 2,538 |
| -10 | 3,347 | 80 | 2,464 |
| 0 | 3,214 | 90 | 2,394 |
| 10 | 3,095 | 100 | 2,328 |
| 20 | 2,985 | 110 | 2,266 |
| 30 | 2,884 | 120 | 2,207 |
| 40 | 2,789 | 130 | 2,15 |
| 50 | 2,7 | 140 | 2,097 |
So zvyšujúcim sa tlakom sa zvyšuje hustota chlóru. Nižšie uvedené tabuľky ukazujú hustotu plynného chlóru v teplotnom rozsahu od -40 do 140 °C a tlaku od 26,6·105 do 213·105 Pa. So zvyšujúcim sa tlakom úmerne rastie hustota chlóru v plynnom stave. Napríklad zvýšenie tlaku chlóru z 53,2·105 na 106,4·105 Pa pri teplote 10 °C vedie k dvojnásobnému zvýšeniu hustoty tohto plynu.
| ↓ t, °С | P, kPa → | 26,6 | 53,2 | 79,8 | 101,3 |
|---|---|---|---|---|
| -40 | 0,9819 | 1,996 | — | — |
| -30 | 0,9402 | 1,896 | 2,885 | 3,722 |
| -20 | 0,9024 | 1,815 | 2,743 | 3,502 |
| -10 | 0,8678 | 1,743 | 2,629 | 3,347 |
| 0 | 0,8358 | 1,678 | 2,528 | 3,214 |
| 10 | 0,8061 | 1,618 | 2,435 | 3,095 |
| 20 | 0,7783 | 1,563 | 2,35 | 2,985 |
| 30 | 0,7524 | 1,509 | 2,271 | 2,884 |
| 40 | 0,7282 | 1,46 | 2,197 | 2,789 |
| 50 | 0,7055 | 1,415 | 2,127 | 2,7 |
| 60 | 0,6842 | 1,371 | 2,062 | 2,616 |
| 70 | 0,6641 | 1,331 | 2 | 2,538 |
| 80 | 0,6451 | 1,292 | 1,942 | 2,464 |
| 90 | 0,6272 | 1,256 | 1,888 | 2,394 |
| 100 | 0,6103 | 1,222 | 1,836 | 2,328 |
| 110 | 0,5943 | 1,19 | 1,787 | 2,266 |
| 120 | 0,579 | 1,159 | 1,741 | 2,207 |
| 130 | 0,5646 | 1,13 | 1,697 | 2,15 |
| 140 | 0,5508 | 1,102 | 1,655 | 2,097 |
| ↓ t, °С | P, kPa → | 133 | 160 | 186 | 213 |
|---|---|---|---|---|
| -20 | 4,695 | 5,768 | — | — |
| -10 | 4,446 | 5,389 | 6,366 | 7,389 |
| 0 | 4,255 | 5,138 | 6,036 | 6,954 |
| 10 | 4,092 | 4,933 | 5,783 | 6,645 |
| 20 | 3,945 | 4,751 | 5,565 | 6,385 |
| 30 | 3,809 | 4,585 | 5,367 | 6,154 |
| 40 | 3,682 | 4,431 | 5,184 | 5,942 |
| 50 | 3,563 | 4,287 | 5,014 | 5,745 |
| 60 | 3,452 | 4,151 | 4,855 | 5,561 |
| 70 | 3,347 | 4,025 | 4,705 | 5,388 |
| 80 | 3,248 | 3,905 | 4,564 | 5,225 |
| 90 | 3,156 | 3,793 | 4,432 | 5,073 |
| 100 | 3,068 | 3,687 | 4,307 | 4,929 |
| 110 | 2,985 | 3,587 | 4,189 | 4,793 |
| 120 | 2,907 | 3,492 | 4,078 | 4,665 |
| 130 | 2,832 | 3,397 | 3,972 | 4,543 |
| 140 | 2,761 | 3,319 | 3,87 | 4,426 |
Hustota kvapalného chlóru
Kvapalný chlór môže existovať v relatívne úzkom teplotnom rozsahu, ktorého hranice ležia od mínus 100,5 do plus 144 °C (to znamená od bodu topenia po kritickú teplotu). Pri teplote vyššej ako 144°C sa chlór pri žiadnom tlaku nepremení na kvapalné skupenstvo. Hustota kvapalného chlóru v tomto teplotnom rozsahu kolíše od 1717 do 573 kg/m3.
| t, °С | ρ, kg/m3 | t, °С | ρ, kg/m3 |
|---|---|---|---|
| -100 | 1717 | 30 | 1377 |
| -90 | 1694 | 40 | 1344 |
| -80 | 1673 | 50 | 1310 |
| -70 | 1646 | 60 | 1275 |
| -60 | 1622 | 70 | 1240 |
| -50 | 1598 | 80 | 1199 |
| -40 | 1574 | 90 | 1156 |
| -30 | 1550 | 100 | 1109 |
| -20 | 1524 | 110 | 1059 |
| -10 | 1496 | 120 | 998 |
| 0 | 1468 | 130 | 920 |
| 10 | 1438 | 140 | 750 |
| 20 | 1408 | 144 | 573 |
Špecifická tepelná kapacita chlóru
Mernú tepelnú kapacitu plynného chlóru C p v kJ/(kg K) v teplotnom rozsahu od 0 do 1200 °C a normálnom atmosférickom tlaku možno vypočítať pomocou vzorca:
kde T je absolútna teplota chlóru v stupňoch Kelvina.
Treba poznamenať, že za normálnych podmienok je merná tepelná kapacita chlóru 471 J/(kg K) a pri zahriatí sa zvyšuje. Zvýšenie tepelnej kapacity pri teplotách nad 500 °C sa stáva nevýznamným a pri vysokých teplotách zostáva špecifické teplo chlóru prakticky nezmenené.
V tabuľke sú uvedené výsledky výpočtu špecifického tepla chlóru pomocou vyššie uvedeného vzorca (chyba výpočtu je asi 1%).
| t, °С | Cp, J/(kg K) | t, °С | Cp, J/(kg K) |
|---|---|---|---|
| 0 | 471 | 250 | 506 |
| 10 | 474 | 300 | 508 |
| 20 | 477 | 350 | 510 |
| 30 | 480 | 400 | 511 |
| 40 | 482 | 450 | 512 |
| 50 | 485 | 500 | 513 |
| 60 | 487 | 550 | 514 |
| 70 | 488 | 600 | 514 |
| 80 | 490 | 650 | 515 |
| 90 | 492 | 700 | 515 |
| 100 | 493 | 750 | 515 |
| 110 | 494 | 800 | 516 |
| 120 | 496 | 850 | 516 |
| 130 | 497 | 900 | 516 |
| 140 | 498 | 950 | 516 |
| 150 | 499 | 1000 | 517 |
| 200 | 503 | 1100 | 517 |
Pri teplotách blízkych absolútnej nule je chlór v pevnom skupenstve a má nízku mernú tepelnú kapacitu (19 J/(kg K)). So zvyšovaním teploty tuhého Cl 2 sa jeho tepelná kapacita zvyšuje a dosahuje hodnotu 720 J/(kg K) pri mínus 143°C.
Kvapalný chlór má mernú tepelnú kapacitu 918...949 J/(kg K) v rozsahu od 0 do -90 stupňov Celzia. Podľa tabuľky je vidieť, že merná tepelná kapacita kvapalného chlóru je vyššia ako u plynného chlóru a so zvyšujúcou sa teplotou klesá.
Tepelná vodivosť chlóru
V tabuľke sú uvedené hodnoty koeficientov tepelnej vodivosti plynného chlóru pri normálnom atmosférickom tlaku v rozsahu teplôt od -70 do 400°C.
Súčiniteľ tepelnej vodivosti chlóru za normálnych podmienok je 0,0079 W/(m deg), čo je 3-krát menej ako pri rovnakej teplote a tlaku. Zahrievanie chlóru vedie k zvýšeniu jeho tepelnej vodivosti. Pri teplote 100°C sa teda hodnota tejto fyzikálnej vlastnosti chlóru zvýši na 0,0114 W/(m deg).
| t, °С | λ, W/(m°) | t, °С | λ, W/(m°) |
|---|---|---|---|
| -70 | 0,0054 | 50 | 0,0096 |
| -60 | 0,0058 | 60 | 0,01 |
| -50 | 0,0062 | 70 | 0,0104 |
| -40 | 0,0065 | 80 | 0,0107 |
| -30 | 0,0068 | 90 | 0,0111 |
| -20 | 0,0072 | 100 | 0,0114 |
| -10 | 0,0076 | 150 | 0,0133 |
| 0 | 0,0079 | 200 | 0,0149 |
| 10 | 0,0082 | 250 | 0,0165 |
| 20 | 0,0086 | 300 | 0,018 |
| 30 | 0,009 | 350 | 0,0195 |
| 40 | 0,0093 | 400 | 0,0207 |
Viskozita chlóru
Koeficient dynamickej viskozity plynného chlóru v teplotnom rozsahu 20...500°C možno približne vypočítať pomocou vzorca:
kde η T je koeficient dynamickej viskozity chlóru pri danej teplote T, K;
η T 0 - koeficient dynamickej viskozity chlóru pri teplote T 0 = 273 K (za normálnych podmienok);
C je Sutherlandova konštanta (pre chlór C = 351).
Za normálnych podmienok je dynamická viskozita chlóru 0,0123·10 -3 Pa·s. Pri zahrievaní nadobúdajú fyzikálne vlastnosti chlóru, ako je viskozita, vyššie hodnoty.
Kvapalný chlór má viskozitu rádovo vyššiu ako plynný chlór. Napríklad pri teplote 20°C má dynamická viskozita kvapalného chlóru hodnotu 0,345·10 -3 Pa·s a so zvyšujúcou sa teplotou klesá.
Zdroje:
- Barkov S. A. Halogény a podskupina mangánu. Prvky skupiny VII periodickej tabuľky D. I. Mendelejeva. Manuál pre študentov. M.: Školstvo, 1976 - 112 s.
- Tabuľky fyzikálnych veličín. Adresár. Ed. akad. I. K. Kikoina. M.: Atomizdat, 1976 - 1008 s.
- Yakimenko L. M., Pasmanik M. I. Príručka o výrobe chlóru, lúhu sodného a zásaditých chlórových produktov. Ed. 2., per. a i. M.: Chémia, 1976 - 440 s.
Chlór bol prvýkrát získaný v roku 1772 Scheele, ktorý opísal jeho uvoľňovanie počas interakcie pyrolusitu s kyselinou chlorovodíkovou vo svojom pojednaní o pyrolusite: 4HCl + MnO 2 = Cl 2 + MnCl 2 + 2H 2 O
Scheele si všimol zápach chlóru, podobný zápachu aqua regia, jeho schopnosť reagovať so zlatom a rumelkou a jeho bieliace vlastnosti. Scheele však v súlade s flogistónovou teóriou, ktorá bola v tom čase dominantná v chémii, navrhol, že chlór je deflogistizovaná kyselina chlorovodíková, teda oxid kyseliny chlorovodíkovej.
Berthollet a Lavoisier navrhli, že chlór je oxid prvku muria, ale pokusy o jeho izoláciu zostali neúspešné až do práce Davyho, ktorému sa podarilo rozložiť kuchynskú soľ na sodík a chlór elektrolýzou.
Názov prvku pochádza z gréčtiny clwroz- "zelená".
Byť v prírode, prijímať:
Prírodný chlór je zmesou dvoch izotopov 35 Cl a 37 Cl. V zemskej kôre je chlór najbežnejším halogénom. Keďže chlór je veľmi aktívny, v prírode sa vyskytuje iba vo forme zlúčenín v mineráloch: halit NaCl, sylvit KCl, sylvinit KCl NaCl, bischofit MgCl 2 6H 2 O, karnallit KCl MgCl 2 6H 2 O, kainit KCl MgSO 4 · 3H 2 O. Najväčšie zásoby chlóru obsahujú soli vôd morí a oceánov.
V priemyselnom meradle sa chlór vyrába spolu s hydroxidom sodným a vodíkom elektrolýzou roztoku kuchynskej soli:
2NaCl + 2H20 => H2 + Cl2 + 2NaOH
Na získanie chlóru z chlorovodíka, ktorý je vedľajším produktom pri priemyselnej chlorácii organických zlúčenín, sa používa proces Deacon (katalytická oxidácia chlorovodíka vzdušným kyslíkom):
4HCl + 02 = 2H20 + 2CI2
Procesy zvyčajne používané v laboratóriách sú založené na oxidácii chlorovodíka silnými oxidačnými činidlami (napríklad oxid manganičitý, manganistan draselný, dvojchróman draselný):
2KMn04 + 16HCl = 5Cl2 + 2MnCl2 + 2KCl +8H20
K2Cr207 + 14HCl = 3Cl2 + 2CrCl3 + 2KCl + 7H20
Fyzikálne vlastnosti:
Za normálnych podmienok je chlór žltozelený plyn s dusivým zápachom. Chlór je výrazne rozpustný vo vode ("chlórová voda"). Pri 20 °C sa v jednom objeme vody rozpustí 2,3 objemu chlóru. Teplota varu = -34 °C; teplota topenia = -101 °C, hustota (plyn, n.s.) = 3,214 g/l.
Chemické vlastnosti:
Chlór je veľmi aktívny - priamo sa spája s takmer všetkými prvkami periodickej tabuľky, kovmi a nekovmi (okrem uhlíka, dusíka, kyslíka a inertných plynov). Chlór je veľmi silné oxidačné činidlo, vytláča menej aktívne nekovy (bróm, jód) z ich zlúčenín vodíkom a kovmi:
Cl2 + 2HBr = Br2 + 2HCl; Cl2 + 2NaI = 12 + 2NaCl
Po rozpustení vo vode alebo zásadách chlór dismutuje a vytvára chlór (a pri zahrievaní chloristú) a chlorovodíkovú kyselinu alebo ich soli.
Cl2 + H20 HC10 + HCl;
Chlór interaguje s mnohými organickými zlúčeninami a vstupuje do substitučných alebo adičných reakcií:
CH3-CH3 + xCl2 => C2H6-xClx + xHCl
CH2=CH2+Cl2 => Cl-CH2-CH2-Cl
C6H6 + Cl2 => C6H6CI + HCl
Chlór má sedem oxidačných stavov: -1, 0, +1, +3, +4, +5, +7.
Najdôležitejšie spojenia:
Chlorovodík HCl- bezfarebný plyn, ktorý dymí vo vzduchu v dôsledku tvorby kvapiek hmly s vodnou parou. Má štipľavý zápach a silne dráždi dýchacie cesty. Obsiahnutý vo vulkanických plynoch a vodách, v žalúdočnej šťave. Chemické vlastnosti závisia od toho, v akom stave sa nachádza (môže byť v plynnom, kvapalnom alebo roztokovom stave). Roztok HCl je tzv kyselina chlorovodíková. Je to silná kyselina a vytláča slabšie kyseliny z ich solí. Soli - chloridy- tuhé kryštalické látky s vysokou teplotou topenia.
Kovalentné chloridy- zlúčeniny chlóru s nekovmi, plynmi, kvapalinami alebo taviteľnými pevnými látkami, ktoré majú charakteristické kyslé vlastnosti, zvyčajne ľahko hydrolyzovateľné vodou za vzniku kyseliny chlorovodíkovej:
PCl5 + 4H20 = H3P04 + 5HCl;
Oxid chlór (I) Cl20., plyn hnedožltej farby s prenikavým zápachom. Ovplyvňuje dýchacie orgány. Ľahko sa rozpúšťa vo vode a vytvára kyselinu chlórnu.
Kyselina chlórna HClO. Existuje iba v riešeniach. Je to slabá a nestabilná kyselina. Ľahko sa rozkladá na kyselinu chlorovodíkovú a kyslík. Silné oxidačné činidlo. Vzniká, keď sa chlór rozpustí vo vode. Soli - chlórnany, nízka stabilita (NaClO*H 2 O sa explozívne rozkladá pri 70 °C), silné oxidačné činidlá. Široko používaný na bielenie a dezinfekciu bieliaci prášok zmesová soľ Ca(Cl)OCl
Kyselina chlórna HClO2, vo voľnej forme je nestabilný, aj v zriedenom vodnom roztoku sa rýchlo rozkladá. Stredne silná kyselina, soli - chloritany sú spravidla bezfarebné a vysoko rozpustné vo vode. Na rozdiel od chlórnanov vykazujú chloritany výrazné oxidačné vlastnosti iba v kyslom prostredí. Najväčšie využitie (na bielenie tkanín a papieroviny) má chloritan sodný NaClO 2 .
Oxid chlóru (IV) ClO2, je zelenožltý plyn s nepríjemným (štipľavým) zápachom, ...
Kyselina chlórová, HClO 3 - vo voľnej forme je nestabilný: disproporcionuje sa na ClO 2 a HClO 4. Soli - chlorečnany; Z nich sú najdôležitejšie chlorečnany sodné, draselné, vápenaté a horečnaté. Sú to silné oxidačné činidlá a po zmiešaní s redukčnými činidlami sú výbušné. Chlorečnan draselný ( Bertholletova soľ) - KClO 3, sa používal na výrobu kyslíka v laboratóriu, ale pre jeho vysokú nebezpečnosť sa už nepoužíval. Roztoky chlorečnanu draselného sa používali ako slabé antiseptikum a vonkajšie liečivé kloktadlo.
Kyselina chloristá HClO4, vo vodných roztokoch je kyselina chloristá najstabilnejšia zo všetkých chlórových kyselín obsahujúcich kyslík. Bezvodá kyselina chloristá, ktorá sa získava použitím koncentrovanej kyseliny sírovej zo 72 % HClO 4, nie je veľmi stabilná. Je to najsilnejšia monoprotická kyselina (vo vodnom roztoku). Soli - chloristany, sa používajú ako oxidačné činidlá (raketové motory na tuhé palivo).
Aplikácia:
Chlór sa používa v mnohých priemyselných odvetviach, vede a potrebách pre domácnosť:
- Pri výrobe polyvinylchloridu, plastových zmesí, syntetického kaučuku;
- Na bielenie látok a papiera;
- Výroba organochlórových insekticídov - látok, ktoré ničia hmyz škodlivý pre plodiny, ale sú bezpečné pre rastliny;
- Na dezinfekciu vody - „chlórovanie“;
- Registrovaný v potravinárskom priemysle ako potravinárska prídavná látka E925;
- Pri chemickej výrobe kyseliny chlorovodíkovej, bielidla, bertholletovej soli, chloridov kovov, jedov, liečiv, hnojív;
- V hutníctve na výrobu čistých kovov: titán, cín, tantal, niób.
Biologická úloha a toxicita:
Chlór je jedným z najdôležitejších biogénnych prvkov a je súčasťou všetkých živých organizmov. U zvierat a ľudí sa ióny chlóru podieľajú na udržiavaní osmotickej rovnováhy, chloridový ión má optimálny polomer na prienik cez bunkovú membránu. Ióny chlóru sú životne dôležité pre rastliny, podieľajú sa na energetickom metabolizme v rastlinách, aktivujú oxidačnú fosforyláciu.
Chlór vo forme jednoduchej látky je jedovatý, ak sa dostane do pľúc, spôsobuje poleptanie pľúcneho tkaniva a udusenie. Pôsobí dráždivo na dýchacie cesty v koncentrácii vo vzduchu asi 0,006 mg/l (t.j. dvojnásobok prahu pre vnímanie zápachu chlóru). Chlór bol jedným z prvých chemických činidiel, ktoré Nemecko použilo v prvej svetovej vojne.
Korotková Y., Shvetsová I.
Štátna univerzita HF Tyumen, skupina 571.
Zdroje: Wikipedia: http://ru.wikipedia.org/wiki/Cl atď.,
Webová stránka Ruskej chemickej technickej univerzity pomenovaná po. D.I. Mendelejev:
Charakteristika prvkov skupiny VII hlavnej podskupiny s použitím chlóru ako príkladu
Všeobecná charakteristika podskupiny
Tabuľka 1. Nomenklatúra prvkov podskupiny VIIA
P-prvky, typické, nekovy (astatín je polokov), halogény.
Elektrónový diagram prvku Hal (Hal ≠ F):
Prvky podskupiny VIIA sú charakterizované nasledujúcimi valenciami:
Tabuľka 2. Valencia
3. Prvky podskupiny VIIA sa vyznačujú nasledujúcimi oxidačnými stavmi:
Tabuľka 3. Oxidačné stavy prvkov
Charakteristika chemického prvku
Chlór je prvkom skupiny VII A. Sériové číslo 17
Relatívna atómová hmotnosť: 35,4527 a. e.m. (g/mol)
 Počet protónov, neutrónov, elektrónov: 17,18,17
Počet protónov, neutrónov, elektrónov: 17,18,17
Atómová štruktúra:
![]()
Elektronický vzorec:
Typické oxidačné stavy: -1, 0, +1, +3, +4, +5, +7
Ionizačná energia: 1254,9(13,01) kJ/mol (eV)
Elektrónová afinita: 349 (kJ/mol)
Elektronegativita podľa Paulinga: 3,20
Charakteristika jednoduchej látky
Typ väzby: kovalentná nepolárna
Diatomická molekula
Izotopy:35CI (75,78 %) a37CI (24,22 %)
Typ kryštálovej mriežky: molekulárna
Termodynamické parametre
Tabuľka 4
Fyzikálne vlastnosti
Tabuľka 5
Chemické vlastnosti
Vodný roztok chlóru je vysoko dismutovaný („chlórová voda“)
Stupeň 1: Cl2 + H20 = HCl + HOCI
2. stupeň: HOCl = HCl + [O] – atómový kyslík
Oxidačná kapacita v podskupine klesá z fluóru na jód = ˃
Chlór je silné oxidačné činidlo:
1. Interakcia s jednoduchými látkami
a) s vodíkom:
Cl2 + H2 = 2 HCl
b) s kovmi:
Cl2 + 2Na = 2NaCl
3Cl2 + 2Fe = 2FeCl3
c) s niektorými menej elektronegatívnymi nekovmi:
3Cl2 + 2P = 2PCI3
Cl2 + S = SCI2
S kyslíkom, uhlíkom a dusíkom priamo s chlórom nereaguje!
2. Interakcia s komplexnými látkami
a) s vodou: pozri vyššie
b) s kyselinami: nereaguje!
c) s alkalickými roztokmi:
v chlade: Cl 2 + 2 NaOH = NaCl + NaClO + H 2 O
pri zahrievaní: 3Cl2 + 6 KOH = 5KCl + KCl03 + 3H20
e) s mnohými organickými látkami:
Cl2 + CH4 = CH3CI + HCl
C6H6 + Cl2 = C6H5CI + HCl
Najdôležitejšie zlúčeniny chlóru
 Chlorovodík, chlorovodík(HCl) je bezfarebný, tepelne stabilný plyn (za normálnych podmienok) štipľavého zápachu, parí vo vlhkom vzduchu, ľahko sa rozpúšťa vo vode (až 500 objemov plynu na objem vody) za vzniku kyseliny chlorovodíkovej (chlorovodíkovej). Pri teplote -114,22 °C prechádza HCl do tuhého stavu. V pevnom stave existuje chlorovodík vo forme dvoch kryštalických modifikácií: ortorombickej, stabilnej a kubickej.
Chlorovodík, chlorovodík(HCl) je bezfarebný, tepelne stabilný plyn (za normálnych podmienok) štipľavého zápachu, parí vo vlhkom vzduchu, ľahko sa rozpúšťa vo vode (až 500 objemov plynu na objem vody) za vzniku kyseliny chlorovodíkovej (chlorovodíkovej). Pri teplote -114,22 °C prechádza HCl do tuhého stavu. V pevnom stave existuje chlorovodík vo forme dvoch kryštalických modifikácií: ortorombickej, stabilnej a kubickej.
Vodný roztok chlorovodíka sa nazýva kyselina chlorovodíková. Po rozpustení vo vode prebiehajú tieto procesy:
HCl g + H 2 O l = H 3 O + l + Cl − l
Proces rozpúšťania je vysoko exotermický. S vodou tvorí HCl azeotropickú zmes. Je to silná monoprotická kyselina. Energeticky interaguje so všetkými kovmi v napäťovej sérii naľavo od vodíka, so zásaditými a amfotérnymi oxidmi, zásadami a soľami, pričom vytvára soli - chloridy:
Mg + 2 HCl -> MgCl2 + H2
FeO + 2 HCl → FeCl2 + H20
Pri vystavení silným oxidačným činidlám alebo počas elektrolýzy má chlorovodík redukčné vlastnosti:
Mn02 + 4 HCl → MnCl2 + Cl2 + 2 H20
Pri zahrievaní sa chlorovodík oxiduje kyslíkom (katalyzátor - chlorid meďnatý CuCl 2):
4 HCl + 02 -> 2 H20 +2 Cl2
Koncentrovaná kyselina chlorovodíková však reaguje s meďou za vzniku monovalentného komplexu medi:
2 Cu + 4 HCl → 2 H + H 2
Zmes 3 objemových dielov koncentrovanej kyseliny chlorovodíkovej a 1 objemového dielu koncentrovanej kyseliny dusičnej sa nazýva „aqua regia“. Aqua regia dokáže dokonca rozpustiť zlato a platinu. Vysoká oxidačná aktivita aqua regia je spôsobená prítomnosťou nitrozylchloridu a chlóru, ktoré sú v rovnováhe s východiskovými látkami:
4 H 3 O + + 3 Cl − + N0 3 − = NOCl + Cl 2 + 6 H20
V dôsledku vysokej koncentrácie chloridových iónov v roztoku sa kov viaže na chloridový komplex, ktorý podporuje jeho rozpúšťanie:
3 Pt + 4 HNO 3 + 18 HCl → 3 H 2 + 4 NO + 8 H 2 O
Chlorovodík je tiež charakterizovaný adičnými reakciami na viacnásobné väzby (elektrofilná adícia):
R-CH=CH2 + HCl -> R-CHCl-CH3
R-C=CH + 2 HCl -> R-CCl2-CH3
Oxidy chlóru- anorganické chemické zlúčeniny chlóru a kyslíka so všeobecným vzorcom: Cl x O y.
Chlór tvorí tieto oxidy: Cl 2 O, Cl 2 O 3, ClO 2, Cl 2 O 4, Cl 2 O 6, Cl 2 O 7. Okrem toho sú známe nasledujúce: radikál ClO s krátkou životnosťou, radikál peroxidu chlóru ClOO a radikál oxidu chlóru ClO4.
V tabuľke nižšie sú uvedené vlastnosti stabilných oxidov chlóru:
Tabuľka 6
| Nehnuteľnosť | Cl20 | ClO2 | CLOClO 3 | Cl206 (l)↔2ClO3 (g) | Cl207 |
| Farba a stav na izbe. teplota | Žltohnedý plyn | Žltozelený plyn | Svetlo žltá kvapalina | Tmavo červená kvapalina | Bezfarebná kvapalina |
| Oxidačný stav chlóru | (+1) | (+4) | (+1), (+7) | (+6) | (+7) |
| T. pl., °C | −120,6 | −59 | −117 | 3,5 | −91,5 |
| Teplota varu, °C | 2,0 | 44,5 | |||
| d(f, 0 °C), g*cm-3 | - | 1,64 | 1,806 | - | 2,02 |
| Vzorka ΔH° (plyn, 298 K), kJ*mol -1 | 80,3 | 102,6 | ~180 | (155) | |
| AG° vzorka (plyn, 298 K), kJ*mol-1 | 97,9 | 120,6 | - | - | - |
| Vzorka S° (plyn, 298 K), J*K-1*mol-1 | 265,9 | 256,7 | 327,2 | - | - |
| Dipólový moment μ, D | 0,78 ± 0,08 | 1,78 ± 0,01 | - | - | 0,72 ± 0,02 |
 Oxid chlóru (I), Dichlóroxid, anhydrid kyseliny chlórnej - zlúčenina chlóru v oxidačnom stupni +1 s kyslíkom.
Oxid chlóru (I), Dichlóroxid, anhydrid kyseliny chlórnej - zlúčenina chlóru v oxidačnom stupni +1 s kyslíkom.
Za normálnych podmienok je to hnedožltý plyn s charakteristickým zápachom pripomínajúcim chlór. Pri teplotách pod 2 °C má kvapalina zlatočervenú farbu. Toxický: ovplyvňuje dýchacie cesty. Spontánne pomaly sa rozkladá:
Výbušný pri vysokých koncentráciách. Hustota za normálnych podmienok je 3,22 kg/m³. Rozpúšťa sa v tetrachlórmetáne. Rozpustný vo vode za vzniku slabej kyseliny chlórnej:
Rýchlo reaguje s alkáliami:
Cl20 + 2NaOH (zried.) = 2NaClO + H20
Oxid chloričitý- kyslý oxid. Pri rozpustení vo vode vzniká kyselina chlórna a chloristá (disproporcionačná reakcia). Zriedené roztoky sú stabilné v tme a na svetle sa pomaly rozkladajú:
 Oxid chloričitý- oxid chlóru ( IV), zlúčenina chlóru a kyslíka, vzorec: ClO2.
Oxid chloričitý- oxid chlóru ( IV), zlúčenina chlóru a kyslíka, vzorec: ClO2.
Za normálnych podmienok je ClO 2 červenožltý plyn s charakteristickým zápachom. Pri teplotách pod 10 °C je ClO 2 červenohnedá kvapalina. Nízka stabilita, na svetle, pri kontakte s oxidačnými činidlami a pri zahriatí exploduje. Necháme dobre rozpustiť vo vode. Kvôli nebezpečenstvu výbuchu sa oxid chloričitý nemôže skladovať ako kvapalina.
Kyslý oxid. Pri rozpustení vo vode vzniká kyselina chlórna a chloristá (disproporcionačná reakcia). Zriedené roztoky sú stabilné v tme a na svetle sa pomaly rozkladajú:
Výsledná kyselina chlórna je veľmi nestabilná a rozkladá sa:
Vykazuje redoxné vlastnosti.
2ClO2 + 5H2S04 (zriedený) + 10FeS04 = 5Fe2 (S04)3 + 2HCl + 4H20
Cl02 + 2NaOH za studena. = NaCl02 + NaCl03 + H20
Cl02 + O3 = Cl03 + O2
ClO 2 reaguje s mnohými organickými zlúčeninami a pôsobí ako stredne silné oxidačné činidlo.
 Kyselina chlórna- HClO, veľmi slabá jednosýtna kyselina, v ktorej má chlór oxidačný stav +1. Existuje iba v riešeniach.
Kyselina chlórna- HClO, veľmi slabá jednosýtna kyselina, v ktorej má chlór oxidačný stav +1. Existuje iba v riešeniach.
Vo vodných roztokoch sa kyselina chlórna čiastočne rozkladá na protón a chlórnanový anión ClO − :
Nestabilný. Kyselina chlórna a jej soli - chlórnany- silné oxidačné činidlá. Reaguje s kyselinou chlorovodíkovou HCl za vzniku molekulárneho chlóru:
HClO + NaOH (zriedený) = NaClO + H20 
Kyselina chlórna- HClO 2, jednosýtna kyselina strednej sily.
Kyselina chlórna HClO 2 vo voľnej forme je nestabilná, aj v zriedenom vodnom roztoku sa rýchlo rozkladá:
Neutralizované alkáliami.
HClO 2 + NaOH (riedený studený) = NaClO 2 + H 2 O
Anhydrid tejto kyseliny nie je známy.
Z jeho solí sa pripraví kyslý roztok - chloritany vzniká v dôsledku interakcie ClO2 s alkáliou:
Vykazuje redoxné vlastnosti.
5HClO2 + 3H2SO4 (zriedený) + 2KMnO4 = 5HClO3 + 2MnSO4 + K2SO4 + 3H2O
 Kyselina chlórová- HClO 3, silná jednosýtna kyselina, v ktorej má chlór oxidačný stav +5. Neprijaté vo voľnej forme; vo vodných roztokoch pri koncentráciách pod 30 % v chlade je celkom stabilný; v koncentrovanejších roztokoch sa rozkladá:
Kyselina chlórová- HClO 3, silná jednosýtna kyselina, v ktorej má chlór oxidačný stav +5. Neprijaté vo voľnej forme; vo vodných roztokoch pri koncentráciách pod 30 % v chlade je celkom stabilný; v koncentrovanejších roztokoch sa rozkladá:
Kyselina chlórna je silné oxidačné činidlo; oxidačná kapacita sa zvyšuje so zvyšujúcou sa koncentráciou a teplotou. HClO 3 sa ľahko redukuje na kyselinu chlorovodíkovú:
HCl03 + 5HCl (konc.) = 3Cl2 + 3H20
HCl03 + NaOH (zriedený) = NaCl03 + H20
Keď zmes SO 2 a vzduchu prechádza cez silne kyslý roztok, vzniká oxid chloričitý:
V 40% kyseline chloristej sa vznieti napríklad filtračný papier.
8. Byť v prírode:
V zemskej kôre je chlór najbežnejším halogénom. Keďže chlór je veľmi aktívny, v prírode sa vyskytuje len vo forme zlúčenín v mineráloch.
Tabuľka 7. Nález v prírode
Tabuľka 7. Formy minerálov
Najväčšie zásoby chlóru sú obsiahnuté v soliach vôd morí a oceánov.
Potvrdenie
Chemické metódy výroby chlóru sú neúčinné a drahé. Dnes majú najmä historický význam. Dá sa získať reakciou manganistanu draselného s kyselinou chlorovodíkovou:
Scheeleho metóda
Pôvodne bol priemyselný spôsob výroby chlóru založený na metóde Scheele, to znamená na reakcii pyrolusitu s kyselinou chlorovodíkovou:
Diakonská metóda
Spôsob výroby chlóru katalytickou oxidáciou chlorovodíka vzdušným kyslíkom.
Elektrochemické metódy
Dnes sa chlór vyrába v priemyselnom meradle spolu s hydroxidom sodným a vodíkom elektrolýzou roztoku kuchynskej soli, ktorej hlavné procesy možno znázorniť súhrnným vzorcom:
Aplikácia
· Okenný profil vyrobený z polymérov s obsahom chlóru
· Hlavnou zložkou bielidiel je voda Labarraco (chlórnan sodný)
· Pri výrobe polyvinylchloridu, plastových zmesí, syntetického kaučuku.
· Výroba organických chlórov. Značná časť vyrobeného chlóru sa spotrebuje na výrobu prípravkov na ochranu rastlín. Jedným z najdôležitejších insekticídov je hexachlórcyklohexán (často nazývaný hexachlóran).
· Používa sa ako bojová chemická látka, ako aj na výrobu iných chemických bojových látok: horčičný plyn, fosgén.
· Na dezinfekciu vody – „chlórovanie“.
· Registrovaný v potravinárskom priemysle ako potravinárska prídavná látka E925.
· Pri chemickej výrobe kyseliny chlorovodíkovej, bielidla, bertholletovej soli, chloridov kovov, jedov, liečiv, hnojív.
· V hutníctve na výrobu čistých kovov: titán, cín, tantal, niób.
· Ako indikátor slnečných neutrín v chlór-argónových detektoroch.
Mnohé rozvinuté krajiny sa snažia obmedziť používanie chlóru v každodennom živote, a to aj preto, že pri spaľovaní odpadu obsahujúceho chlór vzniká značné množstvo dioxínov.