Penambahan klorin. Berada di alam
Klorin mungkin diperoleh oleh para alkemis, tetapi penemuan dan penelitian pertamanya terkait erat dengan nama ahli kimia Swedia terkenal Carl Wilhelm Scheele. Scheele menemukan lima unsur kimia - barium dan mangan (bersama dengan Johan Hahn), molibdenum, tungsten, klorin, dan secara independen dari ahli kimia lain (walaupun kemudian) - tiga unsur lagi: oksigen, hidrogen, dan nitrogen. Pencapaian ini tidak dapat diulangi oleh ahli kimia mana pun setelahnya. Pada saat yang sama, Scheele, yang telah terpilih sebagai anggota Akademi Ilmu Pengetahuan Kerajaan Swedia, adalah seorang apoteker sederhana di Köping, meskipun ia dapat mengambil posisi yang lebih terhormat dan bergengsi. Frederick II Agung sendiri, raja Prusia, menawarinya jabatan profesor kimia di Universitas Berlin. Menolak tawaran menggiurkan tersebut, Scheele berkata: “Saya tidak bisa makan lebih dari yang saya butuhkan, dan apa yang saya peroleh di sini di Köping sudah cukup untuk saya makan.”
Tentu saja, banyak senyawa klorin telah diketahui jauh sebelum Scheele. Unsur ini ditemukan dalam banyak garam, termasuk garam meja yang paling terkenal. Pada tahun 1774, Scheele mengisolasi klorin dalam bentuk bebas dengan memanaskan mineral hitam pirolusit dengan asam klorida pekat: MnO 2 + 4HCl ® Cl 2 + MnCl 2 + 2H 2 O.
Pada awalnya, ahli kimia menganggap klorin bukan sebagai suatu unsur, tetapi sebagai senyawa kimia dari unsur muria yang tidak diketahui (dari bahasa Latin muria - air garam) dengan oksigen. Dipercaya bahwa asam klorida (disebut asam murat) mengandung oksigen yang terikat secara kimia. Hal ini “dibuktikan”, khususnya, oleh fakta berikut: ketika larutan klorin terkena cahaya, oksigen dilepaskan darinya, dan asam klorida tetap berada dalam larutan. Namun, berbagai upaya untuk “merobek” oksigen dari klorin tidak membuahkan hasil. Jadi, belum ada yang bisa mendapatkan karbon dioksida dengan memanaskan klorin dengan batu bara (yang, pada suhu tinggi, “menghilangkan” oksigen dari banyak senyawa yang mengandungnya). Sebagai hasil percobaan serupa yang dilakukan oleh Humphry Davy, Joseph Louis Gay-Lussac dan Louis Jacques Thenard, menjadi jelas bahwa klorin tidak mengandung oksigen dan merupakan zat sederhana. Eksperimen Gay-Lussac, yang menganalisis rasio kuantitatif gas dalam reaksi klorin dengan hidrogen, menghasilkan kesimpulan yang sama.
Pada tahun 1811, Davy mengusulkan nama "klorin" untuk unsur baru - dari bahasa Yunani. "kloros" - kuning-hijau. Ini persis dengan warna klorin. Akar yang sama ada pada kata "klorofil" (dari bahasa Yunani "chloros" dan "phyllon" - daun). Setahun kemudian, Gay-Lussac “mempersingkat” namanya menjadi “klorin.” Namun tetap saja orang Inggris (dan Amerika) menyebut unsur ini “klorin”, sedangkan orang Prancis menyebutnya klor. Orang Jerman, “pembuat undang-undang” kimia sepanjang hampir seluruh abad ke-19, juga mengadopsi nama yang disingkat tersebut. (dalam bahasa Jerman klorin adalah Klor). Pada tahun 1811, fisikawan Jerman Johann Schweiger mengusulkan nama "halogen" untuk klorin (dari bahasa Yunani "hals" - garam, dan "gennao" - melahirkan). Selanjutnya, istilah ini digunakan tidak hanya untuk klorin, tetapi juga untuk semua analognya dari kelompok ketujuh - fluor, brom, yodium, astatin.
Demonstrasi pembakaran hidrogen di atmosfer klorin menarik: terkadang selama percobaan terjadi efek samping yang tidak biasa: terdengar suara mendengung. Paling sering, nyala api berdengung ketika tabung tipis tempat hidrogen disuplai diturunkan ke dalam bejana berbentuk kerucut berisi klorin; hal yang sama berlaku untuk labu bulat, tetapi dalam silinder nyala api biasanya tidak berdengung. Fenomena ini disebut “api bernyanyi”.
Dalam larutan berair, klorin bereaksi sebagian dan agak lambat dengan air; pada 25° C, kesetimbangan: Cl 2 + H 2 O HClO + HCl terbentuk dalam waktu dua hari. Asam hipoklorit terurai dalam cahaya: HClO ® HCl + O. Oksigen atomlah yang bertanggung jawab atas efek pemutihan (klorin yang benar-benar kering tidak memiliki kemampuan ini).
Klorin dalam senyawanya dapat menunjukkan semua bilangan oksidasi - dari –1 hingga +7. Dengan oksigen, klor membentuk sejumlah oksida, semuanya dalam bentuk murni tidak stabil dan mudah meledak: Cl 2 O - gas kuning-oranye, ClO 2 - gas kuning (di bawah 9,7 o C - cairan merah terang), klorin perklorat Cl 2 O 4 (ClO –ClO 3, cairan kuning muda), Cl 2 O 6 (O 2 Cl–O–ClO 3, cairan merah terang), Cl 2 O 7 – cairan tidak berwarna dan sangat mudah meledak. Pada suhu rendah, diperoleh oksida Cl 2 O 3 dan ClO 3 yang tidak stabil. Oksida ClO 2 diproduksi dalam skala industri dan digunakan sebagai pengganti klorin untuk memutihkan pulp dan mendisinfeksi air minum dan air limbah. Dengan halogen lain, klor membentuk sejumlah senyawa interhalogen, misalnya ClF, ClF 3, ClF 5, BrCl, ICl, ICl 3.
Klorin dan senyawanya dengan bilangan oksidasi positif merupakan oksidator kuat. Pada tahun 1822, ahli kimia Jerman Leopold Gmelin memperoleh garam merah dari garam darah kuning melalui oksidasi dengan klorin: 2K 4 + Cl 2 ® K 3 + 2KCl. Klorin dengan mudah mengoksidasi bromida dan klorida, melepaskan brom dan yodium dalam bentuk bebas.
Klorin dalam keadaan oksidasi yang berbeda membentuk sejumlah asam: HCl - hidroklorik (hidroklorik, garam - klorida), HClO - hipoklorit (garam - hipoklorit), HClO 2 - klorat (garam - klorit), HClO 3 - hipoklorit (garam - klorat) , HClO 4 – klorin (garam – perklorat). Dari asam oksigen, hanya asam perklorat yang stabil dalam bentuk murni. Dari garam asam oksigen, hipoklorit digunakan dalam penggunaan praktis, natrium klorit NaClO 2 - untuk memutihkan kain, untuk pembuatan sumber oksigen piroteknik kompak ("lilin oksigen"), kalium klorat (garam Bertholometa), kalsium dan magnesium ( untuk mengendalikan hama pertanian, seperti komponen komposisi kembang api dan bahan peledak, dalam produksi korek api), perklorat - komponen komposisi bahan peledak dan kembang api; Amonium perklorat adalah komponen bahan bakar roket padat.
Klorin bereaksi dengan banyak senyawa organik. Ia dengan cepat melekat pada senyawa tak jenuh dengan ikatan karbon-karbon ganda dan rangkap tiga (reaksi dengan asetilena berlangsung secara eksplosif), dan dalam cahaya menjadi benzena. Dalam kondisi tertentu, klorin dapat menggantikan atom hidrogen dalam senyawa organik: R–H + Cl 2 ® RCl + HCl. Reaksi ini memainkan peran penting dalam sejarah kimia organik. Pada tahun 1840-an, ahli kimia Perancis Jean Baptiste Dumas menemukan bahwa ketika klorin bereaksi dengan asam asetat, reaksi terjadi dengan sangat mudah.
CH 3 COOH + Cl 2 ® CH 2 ClCOOH + HCl. Dengan kelebihan klorin, terbentuk asam trikloroasetat CCl 3 COOH. Namun, banyak ahli kimia yang tidak mempercayai karya Dumas. Memang, menurut teori Berzelius yang diterima secara umum, atom hidrogen yang bermuatan positif tidak dapat digantikan oleh atom klor yang bermuatan negatif. Pendapat ini dianut pada saat itu oleh banyak ahli kimia terkemuka, di antaranya adalah Friedrich Wöhler, Justus Liebig dan, tentu saja, Berzelius sendiri.
Untuk mengejek Dumas, Wöhler menyerahkan kepada temannya Liebig sebuah artikel atas nama S. Windler (Schwindler - dalam bahasa Jerman seorang penipu) tentang penerapan baru yang berhasil dari reaksi yang diduga ditemukan oleh Dumas. Dalam artikel tersebut, Wöhler menulis dengan nada mengejek tentang bagaimana dalam mangan asetat Mn(CH 3 COO) 2 semua elemen, menurut valensinya, dapat diganti dengan klorin, sehingga menghasilkan zat kristal kuning yang hanya terdiri dari klorin. Dikatakan lebih lanjut bahwa di Inggris, dengan mengganti semua atom dalam senyawa organik dengan atom klor secara berturut-turut, kain biasa diubah menjadi kain klor, dan pada saat yang sama benda-benda tetap mempertahankan penampilannya. Dalam catatan kaki disebutkan bahwa toko-toko di London menjual dengan cepat bahan-bahan yang hanya mengandung klorin, karena bahan ini sangat baik untuk topi tidur dan celana dalam yang hangat.
Reaksi klorin dengan senyawa organik mengarah pada pembentukan banyak produk organoklorin, di antaranya adalah pelarut yang banyak digunakan metilen klorida CH 2 Cl 2, kloroform CHCl 3, karbon tetraklorida CCl 4, trikloretilen CHCl=CCl 2, tetrakloroetilen C 2 Cl 4 . Dengan adanya kelembapan, klorin mengubah warna hijau daun tanaman dan banyak pewarna. Ini digunakan pada abad ke-18. untuk memutihkan kain.
Klorin sebagai gas beracun.
Scheele, yang menerima klorin, merasakan bau menyengat yang sangat tidak sedap, kesulitan bernapas dan batuk. Seperti yang kemudian kita ketahui, seseorang mencium bau klorin meskipun satu liter udara hanya mengandung 0,005 mg gas ini, dan pada saat yang sama sudah mengiritasi saluran pernafasan, merusak sel-sel selaput lendir pernafasan. saluran dan paru-paru. Konsentrasi 0,012 mg/l sulit ditoleransi; jika konsentrasi klorin melebihi 0,1 mg/l, hal ini dapat mengancam jiwa: pernapasan menjadi lebih cepat, menjadi kejang, dan kemudian menjadi semakin jarang, dan setelah 5–25 menit pernapasan berhenti. Konsentrasi maksimum yang diijinkan di udara perusahaan industri adalah 0,001 mg/l, dan di udara daerah pemukiman - 0,00003 mg/l.
Akademisi St. Petersburg Toviy Egorovich Lovitz, mengulangi eksperimen Scheele pada tahun 1790, secara tidak sengaja melepaskan sejumlah besar klorin ke udara. Setelah menghirupnya, ia kehilangan kesadaran dan terjatuh, kemudian menderita nyeri dada yang menyiksa selama delapan hari. Untungnya, dia pulih. Ahli kimia terkenal Inggris Davy hampir meninggal karena keracunan klorin. Percobaan dengan klorin dalam jumlah kecil pun berbahaya karena dapat menyebabkan kerusakan paru-paru yang parah. Mereka mengatakan bahwa ahli kimia Jerman Egon Wiberg memulai salah satu ceramahnya tentang klorin dengan kata-kata: “Klorin adalah gas beracun. Jika saya keracunan pada demonstrasi berikutnya, tolong bawa saya ke udara segar. Tapi sayangnya, kuliahnya harus diinterupsi.” Jika Anda melepaskan banyak klorin ke udara, ini akan menjadi bencana yang nyata. Hal ini dialami oleh pasukan Inggris-Prancis pada Perang Dunia Pertama. Pada pagi hari tanggal 22 April 1915, komando Jerman memutuskan untuk melakukan serangan gas pertama dalam sejarah perang: ketika angin bertiup ke arah musuh, di bagian depan kecil sepanjang enam kilometer dekat kota Ypres di Belgia. , katup dari 5.730 silinder dibuka secara bersamaan, masing-masing berisi 30 kg klorin cair. Dalam 5 menit, awan besar berwarna kuning-hijau terbentuk, yang perlahan menjauh dari parit Jerman menuju Sekutu. Tentara Inggris dan Perancis sama sekali tidak berdaya. Gas menembus celah-celah ke semua tempat perlindungan, tidak ada jalan keluar darinya: lagipula, masker gas belum ditemukan. Akibatnya 15 ribu orang keracunan, 5 ribu di antaranya meninggal dunia. Sebulan kemudian, pada tanggal 31 Mei, Jerman mengulangi serangan gas di front timur - terhadap pasukan Rusia. Ini terjadi di Polandia dekat kota Bolimova. Pada jarak 12 km depan, 264 ton campuran klorin dan fosgen yang jauh lebih beracun (asam karbonat klorida COCl 2) dilepaskan dari 12 ribu silinder. Komando Tsar mengetahui apa yang terjadi di Ypres, namun tentara Rusia tidak memiliki alat pertahanan! Akibat serangan gas tersebut, kerugian mencapai 9.146 orang, dimana hanya 108 orang akibat tembakan senapan dan artileri, sisanya keracunan. Pada saat yang sama, 1.183 orang meninggal seketika.
Segera, ahli kimia menunjukkan cara melepaskan diri dari klorin: Anda perlu bernapas melalui perban kasa yang direndam dalam larutan natrium tiosulfat (zat ini digunakan dalam fotografi, sering disebut hiposulfit). Klorin bereaksi sangat cepat dengan larutan tiosulfat, mengoksidasinya:
Na 2 S 2 O 3 + 4Cl 2 + 5H 2 O ® 2H 2 SO 4 + 2NaCl + 6HCl. Tentu saja, asam sulfat juga bukan zat yang tidak berbahaya, tetapi larutan encernya jauh lebih berbahaya dibandingkan klorin beracun. Oleh karena itu, pada tahun-tahun itu, tiosulfat memiliki nama lain - “antiklor”, tetapi masker gas tiosulfat pertama tidak terlalu efektif.
Pada tahun 1916, ahli kimia Rusia dan calon akademisi Nikolai Dmitrievich Zelinsky menemukan masker gas yang benar-benar efektif, di mana zat beracun ditahan oleh lapisan karbon aktif. Batubara dengan permukaan yang sangat berkembang dapat menahan lebih banyak klorin dibandingkan kain kasa yang direndam dalam hiposulfit. Untungnya, “serangan klorin” hanya menjadi episode tragis dalam sejarah. Setelah Perang Dunia, klorin hanya memiliki profesi damai yang tersisa.
Penggunaan klorin.
Setiap tahun, klorin diproduksi dalam jumlah besar di seluruh dunia – puluhan juta ton. Hanya di Amerika pada akhir abad ke-20. Sekitar 12 juta ton klorin diproduksi setiap tahun melalui elektrolisis (tempat ke-10 di antara produksi bahan kimia). Sebagian besar (hingga 50%) dihabiskan untuk klorinasi senyawa organik - untuk produksi pelarut, karet sintetis, polivinil klorida dan plastik lainnya, karet kloroprena, pestisida, obat-obatan, dan banyak produk lain yang diperlukan dan bermanfaat. Sisanya digunakan untuk sintesis klorida anorganik, dalam industri pulp dan kertas untuk pemutihan pulp kayu, dan untuk pemurnian air. Klorin digunakan dalam jumlah yang relatif kecil di industri metalurgi. Dengan bantuannya, logam yang sangat murni diperoleh - titanium, timah, tantalum, niobium. Dengan membakar hidrogen dalam klorin, hidrogen klorida diperoleh, dan asam klorida diperoleh darinya. Klorin juga digunakan untuk produksi bahan pemutih (hipoklorit, pemutih) dan desinfeksi air dengan klorinasi.
Ilya Leenson
DEFINISI
Klorin- elemen ketujuh belas dari Tabel Periodik. Penunjukan - Cl dari bahasa Latin "chlorum". Bertempat di periode ketiga, grup VIIA. Mengacu pada non-logam. Muatan inti adalah 17.
Senyawa klor alami yang paling penting adalah natrium klorida (garam meja) NaCl. Sebagian besar natrium klorida ditemukan di perairan laut dan samudera. Perairan banyak danau juga mengandung sejumlah besar NaCl. Ia juga ditemukan dalam bentuk padat, terbentuk di beberapa tempat di kerak bumi lapisan tebal yang disebut garam batu. Senyawa klor lainnya juga banyak terdapat di alam, misalnya kalium klorida dalam bentuk mineral karnalit KCl × MgCl 2 × 6H 2 O dan silvit KCl.
Dalam kondisi normal, klorin adalah gas berwarna kuning-hijau (Gbr. 1), yang sangat larut dalam air. Ketika didinginkan, kristal hidrat dilepaskan dari larutan berair, yang merupakan klarat dengan komposisi perkiraan Cl 2 × 6H 2 O dan Cl 2 × 8H 2 O.
Beras. 1. Klorin dalam keadaan cair. Penampilan.
Massa atom dan molekul klorin
Massa atom relatif suatu unsur adalah perbandingan massa atom suatu unsur dengan 1/12 massa atom karbon. Massa atom relatif tidak berdimensi dan dilambangkan dengan A r (indeks “r” adalah huruf awal dari kata relatif dalam bahasa Inggris, yang berarti “relatif”). Massa atom relatif atom klor adalah 35,457 sma.
Massa molekul, serta massa atom, dinyatakan dalam satuan massa atom. Massa molekul suatu zat adalah massa suatu molekul, dinyatakan dalam satuan massa atom. Massa molekul relatif suatu zat adalah perbandingan massa molekul suatu zat dengan 1/12 massa atom karbon yang bermassa 12 sma. Diketahui bahwa molekul klor bersifat diatomik - Cl 2. Berat molekul relatif molekul klorin akan sama dengan:
M r (Cl 2) = 35,457 × 2 ≈ 71.
Isotop klorin
Diketahui bahwa di alam klor dapat ditemukan dalam bentuk dua isotop stabil 35 Cl (75,78%) dan 37 Cl (24,22%). Nomor massanya masing-masing adalah 35 dan 37. Inti atom isotop klor 35 Cl mengandung tujuh belas proton dan delapan belas neutron, dan isotop 37 Cl mengandung jumlah proton dan dua puluh neutron yang sama.
Ada isotop klorin buatan dengan nomor massa 35 hingga 43, di antaranya yang paling stabil adalah 36 Cl dengan waktu paruh 301 ribu tahun.
Ion klorin
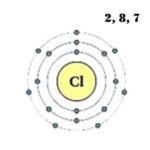
Tingkat energi terluar atom klor memiliki tujuh elektron, yang merupakan elektron valensi:
1s 2 2s 2 2p 6 3s 2 3p 5 .
Akibat interaksi kimia, klorin dapat kehilangan elektron valensinya, mis. menjadi donornya, dan berubah menjadi ion bermuatan positif atau menerima elektron dari atom lain, mis. menjadi akseptornya dan berubah menjadi ion bermuatan negatif:
Cl 0 -7e → Cl 7+ ;
Cl 0 -5e → Cl 5+ ;
Cl 0 -4e → Cl 4+ ;
Cl 0 -3e → Cl 3+ ;
Cl 0 -2e → Cl 2+ ;
Cl 0 -1e → Cl 1+ ;
Cl 0 +1e → Cl 1- .
Molekul dan atom klorin
Molekul klorin terdiri dari dua atom - Cl 2. Berikut beberapa sifat yang menjadi ciri atom dan molekul klor:
Contoh pemecahan masalah
CONTOH 1
| Latihan | Berapa volume klorin yang harus diambil untuk bereaksi dengan 10 liter hidrogen? Gas berada dalam kondisi yang sama. |
| Larutan | Mari kita tuliskan persamaan reaksi antara klorin dan hidrogen: Cl 2 + H 2 = 2HCl. Mari kita hitung jumlah zat hidrogen yang bereaksi: n (H 2) = V (H 2) / V m; n (H 2) = 10 / 22,4 = 0,45 mol. Berdasarkan persamaan, n (H 2) = n (Cl 2) = 0,45 mol. Maka volume klorin yang bereaksi dengan hidrogen adalah: |
Sifat fisik klorin dipertimbangkan: kepadatan klorin, konduktivitas termal, panas spesifik dan viskositas dinamis pada berbagai suhu. Sifat fisik Cl 2 disajikan dalam bentuk tabel wujud cair, padat dan gas halogen ini.
Sifat fisik dasar klorin
Klorin termasuk dalam golongan VII periode ketiga tabel periodik unsur nomor 17. Ia termasuk dalam subkelompok halogen, memiliki massa atom dan molekul relatif masing-masing 35,453 dan 70,906. Pada suhu di atas -30°C, klorin berbentuk gas berwarna kuning kehijauan dengan karakteristik bau yang kuat dan mengiritasi. Ia mudah mencair pada tekanan normal (1,013·10 5 Pa) ketika didinginkan hingga -34°C, dan membentuk cairan kuning bening yang membeku pada -101°C.
Karena aktivitas kimianya yang tinggi, klorin bebas tidak terdapat di alam, tetapi hanya ada dalam bentuk senyawa. Hal ini ditemukan terutama dalam mineral halit (), dan juga merupakan bagian dari mineral seperti silvit (KCl), karnalit (KCl MgCl 2 6H 2 O) dan silvinit (KCl NaCl). Kandungan klor pada kerak bumi mendekati 0,02% dari jumlah atom kerak bumi, dimana terdapat dalam bentuk dua isotop 35 Cl dan 37 Cl dengan perbandingan persentase 75,77% 35 Cl dan 24,23% 37 Cl .
| Properti | Arti |
|---|---|
| Titik lebur, °C | -100,5 |
| Titik didih, °C | -30,04 |
| Suhu kritis, °C | 144 |
| Tekanan kritis, Pa | 77.1 10 5 |
| Kepadatan kritis, kg/m 3 | 573 |
| Massa jenis gas (pada 0°C dan 1,013 · 10 5 Pa), kg/m 3 | 3,214 |
| Massa jenis uap jenuh (pada 0°C dan 3,664 · 10 5 Pa), kg/m 3 | 12,08 |
| Massa jenis klorin cair (pada 0°C dan 3,664 · 10 5 Pa), kg/m 3 | 1468 |
| Massa jenis klorin cair (pada 15,6°C dan 6,08 · 10 5 Pa), kg/m 3 | 1422 |
| Massa jenis klorin padat (pada -102°C), kg/m 3 | 1900 |
| Massa jenis relatif gas di udara (pada 0°C dan 1,013 · 10 5 Pa) | 2,482 |
| Massa jenis relatif uap jenuh di udara (pada 0°C dan 3,664 · 10 5 Pa) | 9,337 |
| Massa jenis relatif klorin cair pada 0°C (relatif terhadap air pada 4°C) | 1,468 |
| Volume spesifik gas (pada 0°C dan 1,013 · 10 5 Pa), m 3 /kg | 0,3116 |
| Volume spesifik uap jenuh (pada 0°C dan 3,664 · 10 5 Pa), m 3 /kg | 0,0828 |
| Volume spesifik klorin cair (pada 0°C dan 3,664 · 10 5 Pa), m 3 /kg | 0,00068 |
| Tekanan uap klorin pada 0°C, Pa | 3.664 10 5 |
| Viskositas dinamis gas pada 20°C, 10 -3 Pa s | 0,013 |
| Viskositas dinamis klorin cair pada 20°C, 10 -3 Pa · s | 0,345 |
| Panas peleburan klorin padat (pada titik leleh), kJ/kg | 90,3 |
| Kalor penguapan (pada titik didih), kJ/kg | 288 |
| Kalor sublimasi (pada titik leleh), kJ/mol | 29,16 |
| Kapasitas panas molar C p gas (pada -73…5727°C), J/(mol K) | 31,7…40,6 |
| Kapasitas panas molar C p klorin cair (pada -101…-34°C), J/(mol K) | 67,1…65,7 |
| Koefisien konduktivitas termal gas pada 0°C, W/(m K) | 0,008 |
| Koefisien konduktivitas termal klorin cair pada 30°C, W/(m K) | 0,62 |
| Entalpi gas, kJ/kg | 1,377 |
| Entalpi uap jenuh, kJ/kg | 1,306 |
| Entalpi klorin cair, kJ/kg | 0,879 |
| Indeks bias pada 14°C | 1,367 |
| Konduktivitas listrik spesifik pada -70°С, S/m | 10 -18 |
| Afinitas elektron, kJ/mol | 357 |
| Energi ionisasi, kJ/mol | 1260 |
Kepadatan Klorin
Dalam kondisi normal, klorin merupakan gas berat dengan kepadatan sekitar 2,5 kali lebih tinggi. Kepadatan klorin gas dan cair pada kondisi normal (0°C) masing-masing sebesar 3,214 dan 1468 kg/m3. Ketika klorin cair atau gas dipanaskan, densitasnya berkurang karena peningkatan volume akibat ekspansi termal.
Kepadatan gas klor
Tabel tersebut menunjukkan kepadatan klorin dalam bentuk gas pada berbagai temperatur (berkisar antara -30 hingga 140°C) dan tekanan atmosfer normal (1,013·10 5 Pa). Kepadatan klorin berubah seiring suhu - berkurang saat dipanaskan. Misalnya, pada 20°C massa jenis klorin adalah 2,985 kg/m3, dan ketika suhu gas ini meningkat hingga 100°C, nilai massa jenisnya menurun hingga nilai 2,328 kg/m 3.
| t, °С | ρ, kg/m3 | t, °С | ρ, kg/m3 |
|---|---|---|---|
| -30 | 3,722 | 60 | 2,616 |
| -20 | 3,502 | 70 | 2,538 |
| -10 | 3,347 | 80 | 2,464 |
| 0 | 3,214 | 90 | 2,394 |
| 10 | 3,095 | 100 | 2,328 |
| 20 | 2,985 | 110 | 2,266 |
| 30 | 2,884 | 120 | 2,207 |
| 40 | 2,789 | 130 | 2,15 |
| 50 | 2,7 | 140 | 2,097 |
Ketika tekanan meningkat, kepadatan klorin meningkat. Tabel di bawah menunjukkan densitas gas klor pada kisaran suhu -40 hingga 140°C dan tekanan dari 26,6·10 5 hingga 213·10 5 Pa. Dengan meningkatnya tekanan, kepadatan klorin dalam bentuk gas meningkat secara proporsional. Misalnya, peningkatan tekanan klor dari 53,2·10 5 menjadi 106,4·10 5 Pa pada suhu 10°C menyebabkan peningkatan densitas gas ini dua kali lipat.
| ↓ t, °С | P, kPa → | 26,6 | 53,2 | 79,8 | 101,3 |
|---|---|---|---|---|
| -40 | 0,9819 | 1,996 | — | — |
| -30 | 0,9402 | 1,896 | 2,885 | 3,722 |
| -20 | 0,9024 | 1,815 | 2,743 | 3,502 |
| -10 | 0,8678 | 1,743 | 2,629 | 3,347 |
| 0 | 0,8358 | 1,678 | 2,528 | 3,214 |
| 10 | 0,8061 | 1,618 | 2,435 | 3,095 |
| 20 | 0,7783 | 1,563 | 2,35 | 2,985 |
| 30 | 0,7524 | 1,509 | 2,271 | 2,884 |
| 40 | 0,7282 | 1,46 | 2,197 | 2,789 |
| 50 | 0,7055 | 1,415 | 2,127 | 2,7 |
| 60 | 0,6842 | 1,371 | 2,062 | 2,616 |
| 70 | 0,6641 | 1,331 | 2 | 2,538 |
| 80 | 0,6451 | 1,292 | 1,942 | 2,464 |
| 90 | 0,6272 | 1,256 | 1,888 | 2,394 |
| 100 | 0,6103 | 1,222 | 1,836 | 2,328 |
| 110 | 0,5943 | 1,19 | 1,787 | 2,266 |
| 120 | 0,579 | 1,159 | 1,741 | 2,207 |
| 130 | 0,5646 | 1,13 | 1,697 | 2,15 |
| 140 | 0,5508 | 1,102 | 1,655 | 2,097 |
| ↓ t, °С | P, kPa → | 133 | 160 | 186 | 213 |
|---|---|---|---|---|
| -20 | 4,695 | 5,768 | — | — |
| -10 | 4,446 | 5,389 | 6,366 | 7,389 |
| 0 | 4,255 | 5,138 | 6,036 | 6,954 |
| 10 | 4,092 | 4,933 | 5,783 | 6,645 |
| 20 | 3,945 | 4,751 | 5,565 | 6,385 |
| 30 | 3,809 | 4,585 | 5,367 | 6,154 |
| 40 | 3,682 | 4,431 | 5,184 | 5,942 |
| 50 | 3,563 | 4,287 | 5,014 | 5,745 |
| 60 | 3,452 | 4,151 | 4,855 | 5,561 |
| 70 | 3,347 | 4,025 | 4,705 | 5,388 |
| 80 | 3,248 | 3,905 | 4,564 | 5,225 |
| 90 | 3,156 | 3,793 | 4,432 | 5,073 |
| 100 | 3,068 | 3,687 | 4,307 | 4,929 |
| 110 | 2,985 | 3,587 | 4,189 | 4,793 |
| 120 | 2,907 | 3,492 | 4,078 | 4,665 |
| 130 | 2,832 | 3,397 | 3,972 | 4,543 |
| 140 | 2,761 | 3,319 | 3,87 | 4,426 |
Kepadatan klorin cair
Klorin cair dapat berada dalam kisaran suhu yang relatif sempit, yang batasnya berkisar antara minus 100,5 hingga plus 144°C (yaitu, dari titik leleh hingga suhu kritis). Di atas suhu 144°C, klorin tidak akan berubah menjadi cair di bawah tekanan apa pun. Kepadatan klorin cair pada kisaran suhu ini bervariasi dari 1717 hingga 573 kg/m3.
| t, °С | ρ, kg/m3 | t, °С | ρ, kg/m3 |
|---|---|---|---|
| -100 | 1717 | 30 | 1377 |
| -90 | 1694 | 40 | 1344 |
| -80 | 1673 | 50 | 1310 |
| -70 | 1646 | 60 | 1275 |
| -60 | 1622 | 70 | 1240 |
| -50 | 1598 | 80 | 1199 |
| -40 | 1574 | 90 | 1156 |
| -30 | 1550 | 100 | 1109 |
| -20 | 1524 | 110 | 1059 |
| -10 | 1496 | 120 | 998 |
| 0 | 1468 | 130 | 920 |
| 10 | 1438 | 140 | 750 |
| 20 | 1408 | 144 | 573 |
Kapasitas panas spesifik klorin
Kapasitas kalor jenis gas klor C p dalam kJ/(kg K) pada kisaran suhu 0 hingga 1200°C dan tekanan atmosfer normal dapat dihitung dengan rumus:
dimana T adalah suhu absolut klorin dalam derajat Kelvin.
Perlu dicatat bahwa dalam kondisi normal kapasitas panas spesifik klorin adalah 471 J/(kg K) dan meningkat bila dipanaskan. Peningkatan kapasitas panas pada suhu di atas 500°C menjadi tidak signifikan, dan pada suhu tinggi panas spesifik klorin hampir tidak berubah.
Tabel menunjukkan hasil penghitungan kalor jenis klorin menggunakan rumus di atas (kesalahan perhitungan sekitar 1%).
| t, °С | C p , J/(kg K) | t, °С | C p , J/(kg K) |
|---|---|---|---|
| 0 | 471 | 250 | 506 |
| 10 | 474 | 300 | 508 |
| 20 | 477 | 350 | 510 |
| 30 | 480 | 400 | 511 |
| 40 | 482 | 450 | 512 |
| 50 | 485 | 500 | 513 |
| 60 | 487 | 550 | 514 |
| 70 | 488 | 600 | 514 |
| 80 | 490 | 650 | 515 |
| 90 | 492 | 700 | 515 |
| 100 | 493 | 750 | 515 |
| 110 | 494 | 800 | 516 |
| 120 | 496 | 850 | 516 |
| 130 | 497 | 900 | 516 |
| 140 | 498 | 950 | 516 |
| 150 | 499 | 1000 | 517 |
| 200 | 503 | 1100 | 517 |
Pada suhu mendekati nol mutlak, klorin berbentuk padat dan memiliki kapasitas panas spesifik yang rendah (19 J/(kg K)). Ketika suhu Cl 2 padat meningkat, kapasitas panasnya meningkat dan mencapai nilai 720 J/(kg K) pada suhu minus 143°C.
Klorin cair memiliki kapasitas panas spesifik 918...949 J/(kg · K) dalam kisaran 0 hingga -90 derajat Celcius. Berdasarkan tabel tersebut terlihat bahwa kapasitas kalor jenis klor cair lebih tinggi dibandingkan dengan klor gas dan menurun seiring dengan meningkatnya suhu.
Konduktivitas termal klorin
Tabel menunjukkan nilai koefisien konduktivitas termal gas klor pada tekanan atmosfer normal dalam kisaran suhu dari -70 hingga 400°C.
Koefisien konduktivitas termal klorin dalam kondisi normal adalah 0,0079 W/(m derajat), yaitu 3 kali lebih kecil dibandingkan pada suhu dan tekanan yang sama. Pemanasan klorin menyebabkan peningkatan konduktivitas termal. Jadi, pada suhu 100°C, nilai sifat fisik klorin meningkat menjadi 0,0114 W/(m derajat).
| t, °С | λ, W/(m derajat) | t, °С | λ, W/(m derajat) |
|---|---|---|---|
| -70 | 0,0054 | 50 | 0,0096 |
| -60 | 0,0058 | 60 | 0,01 |
| -50 | 0,0062 | 70 | 0,0104 |
| -40 | 0,0065 | 80 | 0,0107 |
| -30 | 0,0068 | 90 | 0,0111 |
| -20 | 0,0072 | 100 | 0,0114 |
| -10 | 0,0076 | 150 | 0,0133 |
| 0 | 0,0079 | 200 | 0,0149 |
| 10 | 0,0082 | 250 | 0,0165 |
| 20 | 0,0086 | 300 | 0,018 |
| 30 | 0,009 | 350 | 0,0195 |
| 40 | 0,0093 | 400 | 0,0207 |
Viskositas klorin
Koefisien viskositas dinamis gas klor pada kisaran suhu 20...500°C dapat dihitung secara kasar dengan menggunakan rumus:
dimana η T adalah koefisien viskositas dinamis klorin pada suhu tertentu T, K;
η T 0 - koefisien viskositas dinamis klorin pada suhu T 0 = 273 K (pada kondisi normal);
C adalah konstanta Sutherland (untuk klorin C = 351).
Dalam kondisi normal, viskositas dinamis klorin adalah 0,0123·10 -3 Pa·s. Ketika dipanaskan, sifat fisik klorin, seperti viskositas, menjadi lebih tinggi.
Klorin cair memiliki viskositas yang jauh lebih tinggi daripada klorin gas. Misalnya, pada suhu 20°C, viskositas dinamis klorin cair bernilai 0,345·10 -3 Pa·s dan menurun seiring dengan meningkatnya suhu.
Sumber:
- Barkov S. A. Halogen dan subkelompok mangan. Unsur golongan VII tabel periodik D. I. Mendeleev. Sebuah manual untuk siswa. M.: Pendidikan, 1976 - 112 hal.
- Tabel besaran fisis. Direktori. Ed. acad. I.K.Kikoina. M.: Atomizdat, 1976 - 1008 hal.
- Yakimenko L. M., Pasmanik M. I. Buku Pegangan tentang produksi klorin, soda kaustik, dan produk dasar klorin. Ed. ke-2, jalur. dan lain-lain M.: Kimia, 1976 - 440 hal.
Klorin pertama kali diperoleh pada tahun 1772 oleh Scheele, yang menjelaskan pelepasannya selama interaksi pirolusit dengan asam klorida dalam risalahnya tentang pirolusit: 4HCl + MnO 2 = Cl 2 + MnCl 2 + 2H 2 O
Scheele mencatat bau klorin, mirip dengan aqua regia, kemampuannya bereaksi dengan emas dan cinnabar, serta sifat pemutihannya. Namun, Scheele, sesuai dengan teori flogiston yang dominan dalam bidang kimia pada saat itu, menyatakan bahwa klor adalah asam klorida dephlogistic, yaitu oksida asam klorida.
Berthollet dan Lavoisier mengemukakan bahwa klor adalah oksida dari unsur muria, namun upaya untuk mengisolasinya tetap tidak berhasil sampai karya Davy, yang berhasil menguraikan garam meja menjadi natrium dan klor melalui elektrolisis.
Nama unsur berasal dari bahasa Yunani clwroz- "hijau".
Berada di alam, menerima:
Klorin alami merupakan campuran dua isotop 35 Cl dan 37 Cl. Di kerak bumi, klorin adalah halogen yang paling umum. Karena klor sangat aktif, maka di alam hanya terdapat dalam bentuk senyawa mineral: halit NaCl, silvit KCl, silvinit KCl NaCl, bischofite MgCl 2 6H 2 O, karnalit KCl MgCl 2 6H 2 O, kainite KCl MgSO 4 ·3H 2 O. Cadangan klorin terbesar terkandung dalam garam-garam perairan laut dan samudera.
Pada skala industri, klorin diproduksi bersama dengan natrium hidroksida dan hidrogen melalui elektrolisis larutan garam meja:
2NaCl + 2H 2 O => H 2 + Cl 2 + 2NaOH
Untuk memulihkan klorin dari hidrogen klorida, yang merupakan produk sampingan selama klorinasi industri senyawa organik, proses Deacon digunakan (oksidasi katalitik hidrogen klorida dengan oksigen atmosfer):
4HCl + O 2 = 2H 2 O + 2Cl 2
Proses yang biasanya digunakan di laboratorium didasarkan pada oksidasi hidrogen klorida dengan zat pengoksidasi kuat (misalnya mangan (IV) oksida, kalium permanganat, kalium dikromat):
2KMnO 4 + 16HCl = 5Cl 2 + 2MnCl 2 + 2KCl +8H 2 O
K 2 Cr 2 O 7 + 14HCl = 3Cl 2 + 2CrCl 3 + 2KCl + 7H 2 O
Properti fisik:
Dalam kondisi normal, klorin berbentuk gas berwarna kuning kehijauan dengan bau yang menyesakkan. Klorin sangat larut dalam air ("air klorin"). Pada suhu 20°C, 2,3 volume klorin larut dalam satu volume air. Titik didih = -34°C; titik leleh = -101°C, massa jenis (gas, n.s.) = 3,214 g/l.
Sifat kimia:
Klorin sangat aktif - ia langsung bergabung dengan hampir semua unsur tabel periodik, logam dan non-logam (kecuali karbon, nitrogen, oksigen, dan gas inert). Klorin adalah zat pengoksidasi yang sangat kuat, menggantikan non-logam yang kurang aktif (brom, yodium) dari senyawanya dengan hidrogen dan logam:
Cl 2 + 2HBr = Br 2 + 2HCl; Cl 2 + 2NaI = Saya 2 + 2NaCl
Ketika dilarutkan dalam air atau basa, klorin terurai, membentuk asam hipoklorat (dan bila dipanaskan, perklorat) dan asam klorida, atau garamnya.
Cl 2 + H 2 O HClO + HCl;
Klorin berinteraksi dengan banyak senyawa organik, mengalami reaksi substitusi atau adisi:
CH 3 -CH 3 + xCl 2 => C 2 H 6-x Cl x + xHCl
CH 2 =CH 2 + Cl 2 => Cl-CH 2 -CH 2 -Cl
C 6 H 6 + Cl 2 => C 6 H 6 Cl + HCl
Klorin memiliki tujuh bilangan oksidasi: -1, 0, +1, +3, +4, +5, +7.
Koneksi yang paling penting:
Hidrogen klorida HCl- gas tidak berwarna yang berasap di udara akibat terbentuknya tetesan kabut dengan uap air. Baunya menyengat dan sangat mengiritasi saluran pernapasan. Terkandung dalam gas vulkanik dan air, dalam getah lambung. Sifat kimia bergantung pada wujudnya (bisa dalam bentuk gas, cair, atau larutan). Larutan HCl disebut asam hidroklorik. Ini adalah asam kuat dan menggantikan asam lemah dari garamnya. garam - klorida- zat kristal padat dengan titik leleh tinggi.
Klorida kovalen- senyawa klor dengan nonlogam, gas, cairan atau padatan melebur yang mempunyai sifat asam yang khas, biasanya mudah dihidrolisis oleh air membentuk asam klorida:
PCl 5 + 4H 2 O = H 3 PO 4 + 5HCl;
Klorin(I) oksida Cl 2 O., gas berwarna kuning kecoklatan dengan bau yang menyengat. Mempengaruhi organ pernafasan. Mudah larut dalam air, membentuk asam hipoklorit.
Asam hipoklorit HClO. Hanya ada dalam solusi. Ini adalah asam lemah dan tidak stabil. Mudah terurai menjadi asam klorida dan oksigen. Agen pengoksidasi kuat. Terbentuk ketika klorin dilarutkan dalam air. garam - hipoklorit, stabilitas rendah (NaClO*H 2 O terurai secara eksplosif pada 70 °C), zat pengoksidasi kuat. Banyak digunakan untuk memutihkan dan mendisinfeksi bubuk pemutih, campuran garam Ca(Cl)OCl
Asam klor HClO 2, dalam bentuk bebasnya tidak stabil, bahkan dalam larutan encer ia cepat terurai. Asam berkekuatan sedang, garam - klorit, biasanya, tidak berwarna dan sangat larut dalam air. Tidak seperti hipoklorit, klorit menunjukkan sifat pengoksidasi yang nyata hanya dalam lingkungan asam. Penggunaan terbesar (untuk pemutihan kain dan bubur kertas) adalah natrium klorit NaClO 2.
Klorin(IV) oksida ClO 2, merupakan gas berwarna kuning kehijauan dengan bau yang tidak sedap (menyengat), ...
Asam klorida, HClO 3 - dalam bentuk bebasnya tidak stabil: tidak proporsional menjadi ClO 2 dan HClO 4. garam - klorat; Dari jumlah tersebut, yang paling penting adalah natrium, kalium, kalsium dan magnesium klorat. Ini adalah zat pengoksidasi kuat dan mudah meledak jika dicampur dengan zat pereduksi. Potasium klorat ( garam Berthollet) - KClO 3, digunakan untuk memproduksi oksigen di laboratorium, namun karena bahayanya yang tinggi tidak digunakan lagi. Larutan kalium klorat digunakan sebagai obat kumur antiseptik dan obat luar yang lemah.
Asam perklorat HClO4, dalam larutan air, asam perklorat adalah yang paling stabil dari semua asam klor yang mengandung oksigen. Asam perklorat anhidrat, yang diperoleh dengan menggunakan asam sulfat pekat dari 72% HClO 4, tidak terlalu stabil. Ini adalah asam monoprotik terkuat (dalam larutan air). garam - perklorat, digunakan sebagai oksidator (mesin roket propelan padat).
Aplikasi:
Klorin digunakan di banyak industri, ilmu pengetahuan dan kebutuhan rumah tangga:
- Dalam produksi polivinil klorida, senyawa plastik, karet sintetis;
- Untuk memutihkan kain dan kertas;
- Produksi insektisida organoklorin - zat yang membunuh serangga berbahaya bagi tanaman, namun aman bagi tanaman;
- Untuk desinfeksi air - “klorinasi”;
- Terdaftar di industri makanan sebagai bahan tambahan makanan E925;
- Dalam produksi kimia asam klorida, pemutih, garam berthollet, logam klorida, racun, obat-obatan, pupuk;
- Dalam metalurgi untuk produksi logam murni: titanium, timah, tantalum, niobium.
Peran biologis dan toksisitas:
Klorin adalah salah satu unsur biogenik terpenting dan merupakan bagian dari semua organisme hidup. Pada hewan dan manusia, ion klorin terlibat dalam menjaga keseimbangan osmotik, ion klorida memiliki radius optimal untuk penetrasi melalui membran sel. Ion klorin sangat penting bagi tanaman, berpartisipasi dalam metabolisme energi pada tanaman, mengaktifkan fosforilasi oksidatif.
Klorin dalam bentuk zat sederhana bersifat racun, jika masuk ke paru-paru akan menyebabkan luka bakar pada jaringan paru-paru dan mati lemas. Ini memiliki efek iritasi pada saluran pernapasan pada konsentrasi di udara sekitar 0,006 mg/l (yaitu, dua kali ambang batas persepsi bau klorin). Klorin adalah salah satu bahan kimia pertama yang digunakan Jerman pada Perang Dunia I.
Korotkova Yu., Shvetsova I.
Universitas Negeri HF Tyumen, kelompok 571.
Sumber: Wikipedia: http://ru.wikipedia.org/wiki/Cl, dll.,
Situs web Universitas Teknik Kimia Rusia dinamai demikian. D.I.Mendeleev:
Ciri-ciri unsur golongan VII subkelompok utama, dengan menggunakan klor sebagai contoh
Ciri-ciri umum subgrup
Tabel 1. Tata nama unsur subgolongan VIIA
Unsur P, tipikal, nonlogam (astatin adalah semilogam), halogen.
Diagram elektron unsur Hal (Hal ≠ F):
Unsur-unsur subkelompok VIIA dicirikan oleh valensi berikut:
Tabel 2. Valensi
3. Unsur-unsur subkelompok VIIA dicirikan oleh bilangan oksidasi berikut:
Tabel 3. Keadaan oksidasi unsur
Ciri-ciri suatu unsur kimia
Klorin merupakan salah satu unsur golongan VII A. Nomor seri 17
Massa atom relatif: 35,4527 a. em (g/mol)
 Jumlah proton, neutron, elektron: 17,18,17
Jumlah proton, neutron, elektron: 17,18,17
Struktur atom:
![]()
Rumus elektronik:
Bilangan oksidasi yang umum: -1, 0, +1, +3, +4, +5, +7
Energi ionisasi: 1254,9(13,01) kJ/mol (eV)
Afinitas elektron: 349 (kJ/mol)
Keelektronegatifan menurut Pauling : 3,20
Ciri-ciri zat sederhana
Jenis ikatan: kovalen non-polar
Molekul diatomik
Isotop: 35 Cl (75,78%) dan 37 Cl (24,22%)
Jenis kisi kristal: molekuler
Parameter termodinamika
Tabel 4
Properti fisik
Tabel 5
Sifat kimia
Larutan klorin dalam air sangat terdismutasi (“air klorin”)
Tahap 1: Cl 2 + H 2 O = HCl + HOCl
Tahap 2: HOCl = HCl + [O] – atom oksigen
Kapasitas oksidasi pada subkelompok menurun dari fluor menjadi yodium = ˃
Klorin adalah zat pengoksidasi kuat:
1. Interaksi dengan zat sederhana
a) dengan hidrogen:
Cl 2 + H 2 = 2HCl
b) dengan logam:
Cl 2 + 2Na = 2NaCl
3Cl 2 + 2Fe = 2FeCl 3
c) dengan beberapa nonlogam yang kurang elektronegatif:
3Cl 2 + 2P = 2PCl 3
Cl 2 + S = SCl 2
Dengan oksigen, karbon dan nitrogen, klorin secara langsung tidak bereaksi!
2. Interaksi dengan zat kompleks
a) dengan air: lihat di atas
b) dengan asam: tidak bereaksi!
c) dengan larutan alkali:
dalam cuaca dingin: Cl 2 +2 NaOH = NaCl + NaClO + H 2 O
bila dipanaskan: 3Cl 2 + 6 KOH = 5KCl + KClO 3 + 3H 2 O
e) dengan banyak zat organik:
Cl 2 + CH 4 = CH 3 Cl + HCl
C 6 H 6 + Cl 2 = C 6 H 5 Cl + HCl
Senyawa klorin yang paling penting
 Hidrogen klorida, hidrogen klorida(HCl) adalah gas tidak berwarna, stabil secara termal (dalam kondisi normal) dengan bau menyengat, berasap di udara lembab, mudah larut dalam air (hingga 500 volume gas per volume air) membentuk asam klorida (hidroklorik). Pada suhu −114,22 °C, HCl berubah menjadi padat. Dalam keadaan padat, hidrogen klorida ada dalam bentuk dua modifikasi kristal: ortorombik, stabil di bawah, dan kubik.
Hidrogen klorida, hidrogen klorida(HCl) adalah gas tidak berwarna, stabil secara termal (dalam kondisi normal) dengan bau menyengat, berasap di udara lembab, mudah larut dalam air (hingga 500 volume gas per volume air) membentuk asam klorida (hidroklorik). Pada suhu −114,22 °C, HCl berubah menjadi padat. Dalam keadaan padat, hidrogen klorida ada dalam bentuk dua modifikasi kristal: ortorombik, stabil di bawah, dan kubik.
Larutan hidrogen klorida dalam air disebut asam klorida. Ketika dilarutkan dalam air, terjadi proses berikut:
HCl g + H 2 O l = H 3 O + l + Cl − l
Proses pembubarannya sangat eksotermis. Dengan air, HCl membentuk campuran azeotropik. Ini adalah asam monoprotik kuat. Berinteraksi secara penuh semangat dengan semua logam dalam rangkaian tegangan di sebelah kiri hidrogen, dengan oksida basa dan amfoter, basa dan garam, membentuk garam - klorida:
Mg + 2 HCl → MgCl 2 + H 2
FeO + 2 HCl → FeCl 2 + H 2 O
Ketika terkena zat pengoksidasi kuat atau selama elektrolisis, hidrogen klorida menunjukkan sifat pereduksi:
MnO 2 + 4 HCl → MnCl 2 + Cl 2 + 2 H 2 O
Ketika dipanaskan, hidrogen klorida dioksidasi oleh oksigen (katalis - tembaga(II) klorida CuCl 2):
4 HCl + O 2 → 2 H 2 O +2 Cl 2
Namun, asam klorida pekat bereaksi dengan tembaga membentuk kompleks tembaga monovalen:
2 Cu + 4 HCl → 2 H + H 2
Campuran 3 bagian volume asam klorida pekat dan 1 bagian volume asam nitrat pekat disebut “aqua regia”. Aqua regia bahkan bisa melarutkan emas dan platinum. Aktivitas oksidatif aqua regia yang tinggi disebabkan oleh adanya nitrosil klorida dan klorin di dalamnya, yang berada dalam kesetimbangan dengan zat awal:
4 H 3 O + + 3 Cl − + NO 3 − = NOCl + Cl 2 + 6 H 2 O
Karena tingginya konsentrasi ion klorida dalam larutan, logam berikatan menjadi kompleks klorida, yang mendorong pembubarannya:
3 Pt + 4 HNO 3 + 18 HCl → 3 H 2 + 4 NO + 8 H 2 O
Hidrogen klorida juga dicirikan oleh reaksi adisi pada ikatan rangkap (adisi elektrofilik):
R-CH=CH 2 + HCl → R-CHCl-CH 3
R-C≡CH + 2 HCl → R-CCl 2 -CH 3
Klorin oksida- senyawa kimia anorganik klorin dan oksigen, dengan rumus umum : Cl x O y.
Klorin membentuk oksida berikut: Cl 2 O, Cl 2 O 3, ClO 2, Cl 2 O 4, Cl 2 O 6, Cl 2 O 7. Selain itu, diketahui pula hal-hal berikut ini: radikal berumur pendek ClO, radikal klor peroksida ClOO dan radikal klor tetroksida ClO 4 .
Tabel di bawah ini menunjukkan sifat-sifat oksida klor yang stabil:
Tabel 6
| Properti | Cl2O | ClO2 | ClOClO3 | Cl 2 O 6 (l)↔2ClO 3 (g) | Cl2O7 |
| Warna dan kondisi ruangan. suhu | Gas berwarna kuning kecokelatan | Gas kuning-hijau | Cairan kuning muda | Cairan berwarna merah tua | Cairan tidak berwarna |
| Keadaan oksidasi klorin | (+1) | (+4) | (+1), (+7) | (+6) | (+7) |
| T.pl., °C | −120,6 | −59 | −117 | 3,5 | −91,5 |
| Suhu mendidih, °C | 2,0 | 44,5 | |||
| D(f, 0°C), g*cm -3 | - | 1,64 | 1,806 | - | 2,02 |
| sampel ΔH° (gas, 298 K), kJ*mol -1 | 80,3 | 102,6 | ~180 | (155) | |
| sampel ΔG° (gas, 298 K), kJ*mol -1 | 97,9 | 120,6 | - | - | - |
| S° sampel (gas, 298 K), J*K -1 *mol -1 | 265,9 | 256,7 | 327,2 | - | - |
| Momen dipol μ, D | 0,78 ± 0,08 | 1,78 ± 0,01 | - | - | 0,72 ± 0,02 |
 Klorin oksida (I), Diklor oksida, asam hipoklorit anhidrida - senyawa klorin dalam keadaan oksidasi +1 dengan oksigen.
Klorin oksida (I), Diklor oksida, asam hipoklorit anhidrida - senyawa klorin dalam keadaan oksidasi +1 dengan oksigen.
Dalam kondisi normal, gas ini berwarna kuning kecoklatan dengan bau khas yang mengingatkan pada klorin. Pada suhu di bawah 2 °C cairan berwarna merah keemasan. Beracun: mempengaruhi saluran pernapasan. Terurai perlahan secara spontan:
Mudah meledak pada konsentrasi tinggi. Massa jenis pada kondisi normal adalah 3,22 kg/m³. Larut dalam karbon tetraklorida. Larut dalam air membentuk asam hipoklorit lemah:
Bereaksi cepat dengan basa:
Cl 2 O + 2NaOH (dil.) = 2NaClO + H 2 O
Klorin dioksida- oksida asam. Ketika dilarutkan dalam air, asam klor dan perklorat terbentuk (reaksi disproporsionasi). Larutan encer stabil dalam gelap dan terurai perlahan dalam terang:
 Klorin dioksida- klorin oksida ( IV), senyawa klorin dan oksigen, rumus: ClO 2.
Klorin dioksida- klorin oksida ( IV), senyawa klorin dan oksigen, rumus: ClO 2.
Dalam kondisi normal, ClO 2 berbentuk gas berwarna kuning kemerahan dengan bau yang khas. Pada suhu di bawah 10 °C, ClO 2 berbentuk cairan berwarna merah kecoklatan. Stabilitas rendah, meledak jika terkena cahaya, jika bersentuhan dengan zat pengoksidasi, dan jika dipanaskan. Mari kita larut dengan baik dalam air. Karena bahaya ledakannya, klorin dioksida tidak dapat disimpan dalam bentuk cair.
Oksida asam. Ketika dilarutkan dalam air, asam klor dan perklorat terbentuk (reaksi disproporsionasi). Larutan encer stabil dalam gelap dan terurai perlahan dalam terang:
Asam klor yang dihasilkan sangat tidak stabil dan terurai:
Menunjukkan sifat redoks.
2ClO 2 + 5H 2 SO 4 (encer) + 10FeSO 4 = 5Fe 2 (SO 4) 3 + 2HCl + 4H 2 O
ClO 2 + 2NaOH dingin. = NaClO 2 + NaClO 3 + H 2 O
ClO 2 + O 3 = ClO 3 + O 2
ClO 2 bereaksi dengan banyak senyawa organik dan bertindak sebagai zat pengoksidasi kekuatan sedang.
 Asam hipoklorit- HClO, asam monoprotik yang sangat lemah dimana klorin memiliki bilangan oksidasi +1. Hanya ada dalam solusi.
Asam hipoklorit- HClO, asam monoprotik yang sangat lemah dimana klorin memiliki bilangan oksidasi +1. Hanya ada dalam solusi.
Dalam larutan air, asam hipoklorit terurai sebagian menjadi proton dan anion hipoklorit ClO − :
Tidak stabil. Asam hipoklorit dan garamnya - hipoklorit- zat pengoksidasi kuat. Bereaksi dengan asam klorida HCl, membentuk molekul klorin:
HClO + NaOH (encer) = NaClO + H 2 O 
Asam klor- HClO 2, asam monobasa dengan kekuatan sedang.
Asam klor HClO 2 dalam bentuk bebasnya tidak stabil; bahkan dalam larutan encer, ia cepat terurai:
Dinetralkan oleh alkali.
HClO 2 + NaOH (dil. dingin) = NaClO 2 + H 2 O
Anhidrida asam ini tidak diketahui.
Larutan asam dibuat dari garamnya - klorit terbentuk sebagai hasil interaksi ClO 2 dengan alkali:
Menunjukkan sifat redoks.
5HClO2 + 3H2SO4 (diencerkan) + 2KMnO4 = 5HClO3 + 2MnSO4 + K2SO4 + 3H2O
 Asam klorida- HClO 3, asam monobasa kuat dimana klorin memiliki bilangan oksidasi +5. Tidak diterima dalam bentuk bebas; dalam larutan air pada konsentrasi di bawah 30% dalam suhu dingin cukup stabil; dalam larutan yang lebih pekat ia terurai:
Asam klorida- HClO 3, asam monobasa kuat dimana klorin memiliki bilangan oksidasi +5. Tidak diterima dalam bentuk bebas; dalam larutan air pada konsentrasi di bawah 30% dalam suhu dingin cukup stabil; dalam larutan yang lebih pekat ia terurai:
Asam hipoklorit adalah zat pengoksidasi kuat; kapasitas oksidasi meningkat dengan meningkatnya konsentrasi dan suhu. HClO 3 mudah direduksi menjadi asam klorida:
HClO 3 + 5HCl (konsentrasi) = 3Cl 2 + 3H 2 O
HClO 3 + NaOH (encer) = NaClO 3 + H 2 O
Ketika campuran SO 2 dan udara dilewatkan melalui larutan asam kuat, klor dioksida terbentuk:
Dalam asam perklorat 40%, kertas saring, misalnya, terbakar.
8. Berada di alam:
Di kerak bumi, klorin adalah halogen yang paling umum. Karena klorin sangat aktif, klorin hanya terdapat di alam dalam bentuk senyawa mineral.
Tabel 7. Berada di alam
Tabel 7. Bentuk mineral
Cadangan klorin terbesar terkandung dalam garam-garam perairan laut dan samudera.
Kuitansi
Metode kimia untuk memproduksi klorin tidak efektif dan mahal. Saat ini, mereka terutama memiliki makna sejarah. Dapat diperoleh dengan mereaksikan kalium permanganat dengan asam klorida:
metode Scheele
Awalnya, metode industri untuk memproduksi klorin didasarkan pada metode Scheele, yaitu reaksi pirolusit dengan asam klorida:
Metode Diakon
Metode untuk memproduksi klorin dengan oksidasi katalitik hidrogen klorida dengan oksigen atmosfer.
Metode elektrokimia
Saat ini, klorin diproduksi dalam skala industri bersama dengan natrium hidroksida dan hidrogen melalui elektrolisis larutan garam meja, proses utamanya dapat direpresentasikan dengan rumus ringkasan:
Aplikasi
· Profil jendela terbuat dari polimer yang mengandung klorin
· Komponen utama pemutih adalah air Labaraco (natrium hipoklorit)
· Dalam produksi polivinil klorida, senyawa plastik, karet sintetis.
· Produksi organoklorin. Sebagian besar klorin yang dihasilkan dikonsumsi untuk memperoleh produk perlindungan tanaman. Salah satu insektisida yang paling penting adalah hexachlorocyclohexane (sering disebut hexachlorane).
· Digunakan sebagai bahan perang kimia, serta untuk produksi bahan perang kimia lainnya: gas mustard, fosgen.
· Untuk desinfeksi air - “klorinasi”.
· Terdaftar di industri makanan sebagai bahan tambahan makanan E925.
· Dalam produksi kimia asam klorida, pemutih, garam berthollet, logam klorida, racun, obat-obatan, pupuk.
· Dalam metalurgi untuk produksi logam murni: titanium, timah, tantalum, niobium.
· Sebagai indikator neutrino matahari pada detektor klorin-argon.
Banyak negara maju yang berupaya membatasi penggunaan klorin dalam kehidupan sehari-hari, termasuk karena pembakaran limbah yang mengandung klorin menghasilkan dioksin dalam jumlah besar.