Dodatak hlora. Biti u prirodi
Hlor su vjerovatno dobili alhemičari, ali njegovo otkriće i prvo istraživanje neraskidivo je povezano s imenom poznatog švedskog hemičara Carla Wilhelma Scheelea. Šele je otkrio pet hemijskih elemenata - barijum i mangan (zajedno sa Johanom Hanom), molibden, volfram, hlor, i nezavisno od drugih hemičara (iako kasnije) - još tri: kiseonik, vodonik i azot. Ovo postignuće nije mogao ponoviti nijedan hemičar naknadno. U isto vrijeme, Scheele, već izabran za člana Kraljevske švedske akademije nauka, bio je jednostavan farmaceut u Köpingu, iako je mogao zauzeti časniju i prestižniju poziciju. Sam Fridrik II Veliki, pruski kralj, ponudio mu je mesto profesora hemije na Univerzitetu u Berlinu. Odbijajući takve primamljive ponude, Šele je rekao: „Ne mogu da jedem više nego što mi je potrebno, a ono što zaradim ovde u Köpingu dovoljno mi je da jedem.
Brojna jedinjenja hlora bila su poznata, naravno, mnogo pre Šelea. Ovaj element je dio mnogih soli, uključujući najpoznatiju - kuhinjsku sol. Godine 1774. Scheele je izolovao hlor u slobodnom obliku zagrijavanjem crnog minerala piroluzita sa koncentriranom hlorovodoničnom kiselinom: MnO 2 + 4HCl ® Cl 2 + MnCl 2 + 2H 2 O.
U početku, kemičari su hlor smatrali ne elementom, već kemijskim spojem nepoznatog elementa muria (od latinskog muria - slana otopina) s kisikom. Vjerovalo se da hlorovodonična kiselina (nazvana je murična kiselina) sadrži hemijski vezan kiseonik. O tome je “svjedočila”, posebno, sljedeća činjenica: kada je otopina hlora stajala na svjetlosti, iz nje se oslobađao kisik, a hlorovodonična kiselina je ostajala u otopini. Međutim, brojni pokušaji da se kisik "otrgne" od hlora nikuda nisu doveli. Dakle, niko nije uspeo da dobije ugljen-dioksid zagrevanjem hlora sa ugljem (koji na visokim temperaturama „oduzima“ kiseonik mnogim jedinjenjima koja ga sadrže). Kao rezultat sličnih eksperimenata koje su izveli Humphry Davy, Joseph Louis Gay-Lussac i Louis Jacques Thenard, postalo je jasno da hlor ne sadrži kisik i da je jednostavna tvar. Eksperimenti Gay-Lussaca, koji je analizirao kvantitativni odnos gasova u reakciji hlora sa vodonikom, doveli su do istog zaključka.
Godine 1811. Davy je predložio naziv "hlorin" za novi element - iz grčkog. "kloros" - žuto-zeleni. Ovo je upravo boja hlora. Isti korijen je u riječi "hlorofil" (od grčkog "chloros" i "phyllon" - list). Godinu dana kasnije, Gay-Lussac je "skratio" naziv u "hlor". Ipak, Britanci (i Amerikanci) ovaj element zovu "hlor", dok ga Francuzi zovu hlor. Nemci, „zakonodavci“ hemije tokom skoro čitavog 19. veka, takođe su usvojili skraćeni naziv. (na njemačkom klor je hlor). Godine 1811. njemački fizičar Johann Schweiger predložio je naziv "halogen" za klor (od grčkog "hals" - sol i "gennao" - rađati). Nakon toga, ovaj termin je dodijeljen ne samo kloru, već i svim njegovim analozima u sedmoj grupi - fluoru, bromu, jodu, astatinu.
Zanimljiva je demonstracija sagorevanja vodonika u atmosferi hlora: ponekad se tokom eksperimenta javlja neobična nuspojava: čuje se zujanje. Najčešće, plamen bruji kada se tanka cijev kroz koju se dovodi vodonik spusti u posudu u obliku stošca napunjenu hlorom; isto važi i za sferične tikvice, ali u cilindrima plamen obično ne bruji. Ovaj fenomen je nazvan „plamen koji pjeva“.
U vodenom rastvoru, hlor reaguje delimično i prilično sporo sa vodom; na 25°C, ravnoteža: Cl 2 + H 2 O HClO + HCl se uspostavlja u roku od dva dana. Hipohlorna kiselina se razlaže na svetlosti: HClO ® HCl + O. Za efekat izbeljivanja pripisuje se atomski kiseonik (apsolutno suvi hlor nema tu sposobnost).
Klor u svojim jedinjenjima može pokazati sva oksidaciona stanja - od –1 do +7. Sa kiseonikom hlor formira brojne okside, svi u čistom obliku su nestabilni i eksplozivni: Cl 2 O - žuto-narandžasti gas, ClO 2 - žuti gas (ispod 9,7 o C - svetlo crvena tečnost), hlor perhlorat Cl 2 O 4 (ClO –ClO 3, svetlo žuta tečnost), Cl 2 O 6 (O 2 Cl–O–ClO 3, svetlo crvena tečnost), Cl 2 O 7 – bezbojna, veoma eksplozivna tečnost. Pri niskim temperaturama dobijeni su nestabilni oksidi Cl 2 O 3 i ClO 3. ClO 2 oksid se proizvodi u industrijskim razmjerima i koristi se umjesto klora za izbjeljivanje pulpe i dezinfekciju vode za piće i otpadnih voda. Sa drugim halogenima, hlor stvara niz takozvanih interhalogenih spojeva, na primjer, ClF, ClF 3, ClF 5, BrCl, ICl, ICl 3.
Klor i njegovi spojevi s pozitivnim oksidacijskim stanjem jaki su oksidanti. Godine 1822. njemački hemičar Leopold Gmelin dobio je crvenu sol iz žute krvne soli oksidacijom hlorom: 2K 4 + Cl 2 ® K 3 + 2KCl. Klor lako oksidira bromide i kloride, oslobađajući brom i jod u slobodnom obliku.
Klor u različitim oksidacionim stanjima formira brojne kiseline: HCl - hlorovodonična (hlorovodonična, soli - hloridi), HClO - hipohlorna (soli - hipohloriti), HClO 2 - hlorna (soli - hloriti), HClO 3 - hipohlorna (soli - hlorati) , HClO 4 – hlor (soli – perhlorati). Od kisikovih kiselina, samo je perhlorna kiselina stabilna u svom čistom obliku. Od soli kiseonikovih kiselina u praktičnu upotrebu koriste se hipohlorit, natrijum hlorit NaClO 2 - za izbeljivanje tkanina, za proizvodnju kompaktnih pirotehničkih izvora kiseonika ("kiseoničke sveće"), kalijum hlorata (Bertolometa sol), kalcijuma i magnezijuma ( za suzbijanje poljoprivrednih štetočina, kao što su komponente pirotehničkih sredstava i eksploziva, u proizvodnji šibica), perhlorati - komponente eksploziva i pirotehničkih sredstava; Amonijum perhlorat je komponenta čvrstih raketnih goriva.
Hlor reaguje sa mnogim organskim jedinjenjima. Brzo se vezuje za nezasićena jedinjenja sa dvostrukim i trostrukim vezama ugljik-ugljik (reakcija s acetilenom se odvija eksplozivno), a na svjetlu i za benzen. Pod određenim uslovima, hlor može da zameni atome vodonika u organskim jedinjenjima: R–H + Cl 2 ® RCl + HCl. Ova reakcija je odigrala značajnu ulogu u istoriji organske hemije. 1840-ih, francuski hemičar Jean Baptiste Dumas otkrio je da kada hlor reaguje sa sirćetnom kiselinom, reakcija se dešava sa neverovatnom lakoćom
CH 3 COOH + Cl 2 ® CH 2 ClCOOH + HCl. Sa viškom hlora nastaje trihloroctena kiselina CCl 3 COOH. Međutim, mnogi hemičari su bili nepoverljivi prema Dumasovom radu. Zaista, prema tada općeprihvaćenoj Berzeliusovoj teoriji, pozitivno nabijeni atomi vodika ne mogu se zamijeniti negativno nabijenim atomima hlora. Ovog su mišljenja u to vrijeme imali mnogi istaknuti hemičari, među kojima su bili Friedrich Wöhler, Justus Liebig i, naravno, sam Berzelius.
Da bi ismijao Dumasa, Wöhler je svom prijatelju Liebigu predao članak u ime izvjesnog S. Windlera (Schwindler - na njemačkom prevarant) o novoj uspješnoj primjeni reakcije koju je navodno otkrio Dumas. Wöhler je u članku s očiglednim podsmjehom pisao o tome kako je u mangan acetatu Mn(CH 3 COO) 2 bilo moguće zamijeniti sve elemente, prema njihovoj valenciji, hlorom, što je rezultiralo žutom kristalnom supstancom koja se sastoji samo od hlora. Dalje je rečeno da se u Engleskoj, sukcesivnom zamjenom svih atoma u organskim jedinjenjima atomima hlora, obične tkanine pretvaraju u hlorne, a da istovremeno stvari zadržavaju svoj izgled. U fusnoti je navedeno da su londonske prodavnice brzo prodavale materijal koji se sastoji samo od hlora, jer je ovaj materijal bio veoma dobar za noćne kape i tople gaće.
Reakcija hlora sa organskim jedinjenjima dovodi do stvaranja mnogih organoklornih produkata, među kojima su široko rasprostranjeni rastvarači metilen hlorid CH 2 Cl 2, hloroform CHCl 3, ugljen-tetrahlorid CCl 4, trihloretilen CHCl=CCl 2, tetrahloretilen C 2 Cl 4 . U prisustvu vlage, hlor obezboji zeleno lišće biljaka i mnoge boje. Ovo je korišćeno još u 18. veku. za izbjeljivanje tkanina.
Hlor kao otrovni gas.
Scheele, koji je primio hlor, primijetio je vrlo neprijatan jak miris, otežano disanje i kašalj. Kako smo kasnije saznali, čovjek osjeti miris hlora čak i ako jedan litar zraka sadrži samo 0,005 mg ovog plina, a pritom već djeluje iritativno na respiratorni trakt, uništavajući stanice sluzokože dišnih puteva. trakta i pluća. Koncentracija od 0,012 mg/l teško se podnosi; ako koncentracija hlora prelazi 0,1 mg/l, postaje opasna po život: disanje se ubrzava, postaje konvulzivno, a zatim postaje sve rjeđe, a nakon 5-25 minuta disanje prestaje. Maksimalno dozvoljena koncentracija u vazduhu industrijskih preduzeća je 0,001 mg/l, au vazduhu stambenih naselja - 0,00003 mg/l.
Akademik iz Sankt Peterburga Toviy Egorovich Lovitz, ponavljajući Scheeleov eksperiment 1790. godine, slučajno je ispustio značajnu količinu hlora u zrak. Nakon što ga je udahnuo, izgubio je svijest i pao, a zatim je osam dana patio od strašnih bolova u grudima. Srećom, oporavio se. Čuveni engleski hemičar Davy zamalo nije umro od trovanja hlorom. Eksperimenti sa čak i malim količinama hlora su opasni, jer mogu izazvati ozbiljna oštećenja pluća. Kažu da je njemački hemičar Egon Wiberg jedno od svojih predavanja o hloru započeo riječima: „Hlor je otrovan gas. Ako se otrujem tokom sledeće demonstracije, izvedite me na svež vazduh. Ali, nažalost, predavanje će morati biti prekinuto.” Ako ispustite mnogo hlora u vazduh, to postaje prava katastrofa. To su doživjele englesko-francuske trupe tokom Prvog svjetskog rata. Ujutro 22. aprila 1915. godine, nemačka komanda odlučila je da izvrši prvi gasni napad u istoriji ratova: kada je vetar zapuhao prema neprijatelju, na mali deo fronta od šest kilometara kod belgijskog grada Ypresa. , istovremeno su otvoreni ventili 5.730 cilindara, od kojih je svaki sadržavao 30 kg tečnog hlora. U roku od 5 minuta formirao se ogroman žuto-zeleni oblak, koji se polako udaljavao od njemačkih rovova prema Saveznicima. Engleski i francuski vojnici bili su potpuno bespomoćni. Plin je prodirao kroz pukotine u sva skloništa, iz njega se nije moglo pobjeći: na kraju krajeva, gas maska još nije bila izmišljena. Kao rezultat toga, 15 hiljada ljudi je otrovano, od kojih 5 hiljada na smrt. Mjesec dana kasnije, 31. maja, Nemci su ponovili gasni napad na istočnom frontu - protiv ruskih trupa. To se dogodilo u Poljskoj u blizini grada Bolimova. Na frontu od 12 km, iz 12 hiljada cilindara ispušteno je 264 tone mješavine hlora i mnogo otrovnijeg fosgena (hlorid ugljične kiseline COCl 2). Carska komanda je znala za ono što se dogodilo na Ypresu, a ipak ruski vojnici nisu imali sredstva za odbranu! Usljed gasnog napada, gubici su iznosili 9.146 ljudi, od kojih je samo 108 posljedica granatiranja iz pušaka i artiljerije, ostali su otrovani. Istovremeno, skoro odmah su umrle 1.183 osobe.
Ubrzo su kemičari pokazali kako pobjeći od klora: trebate disati kroz zavoj od gaze natopljen otopinom natrijevog tiosulfata (ova tvar se koristi u fotografiji, često se naziva hiposulfit). Klor vrlo brzo reagira s otopinom tiosulfata, oksidirajući ga:
Na 2 S 2 O 3 + 4Cl 2 + 5H 2 O ® 2H 2 SO 4 + 2NaCl + 6HCl. Naravno, sumporna kiselina također nije bezopasna tvar, ali njezina razrijeđena vodena otopina je mnogo manje opasna od otrovnog hlora. Stoga je tih godina tiosulfat imao drugo ime - "antihlor", ali prve tiosulfatne gas maske nisu bile baš efikasne.
Godine 1916. ruski hemičar i budući akademik Nikolaj Dmitrijevič Zelinski izumio je zaista efikasnu gas masku, u kojoj su otrovne tvari zadržane slojem aktivnog uglja. Takav ugalj sa vrlo razvijenom površinom mogao bi zadržati znatno više hlora od gaze natopljene hiposulfitom. Na sreću, „napadi hlorom“ su ostali samo tragična epizoda u istoriji. Nakon svjetskog rata hloru su ostale samo miroljubive profesije.
Upotreba hlora.
Svake godine se širom svijeta proizvode ogromne količine hlora – desetine miliona tona. Samo u SAD krajem 20. veka. Godišnje se elektrolizom proizvodi oko 12 miliona tona hlora (10. mjesto među hemijskom proizvodnjom). Najveći dio (do 50%) troši se na hloriranje organskih spojeva - za proizvodnju otapala, sintetičke gume, polivinil hlorida i druge plastike, hloroprenske gume, pesticida, lijekova i mnogih drugih potrebnih i korisnih proizvoda. Ostatak se troši za sintezu neorganskih hlorida, u industriji celuloze i papira za izbjeljivanje drvne celuloze i za prečišćavanje vode. Klor se koristi u relativno malim količinama u metalurškoj industriji. Uz njegovu pomoć dobijaju se vrlo čisti metali - titan, kalaj, tantal, niobijum. Spaljivanjem vodonika u hloru dobija se hlorovodonik, a iz njega se dobija hlorovodonična kiselina. Klor se također koristi za proizvodnju sredstava za izbjeljivanje (hipohloriti, izbjeljivači) i dezinfekciju vode hloriranjem.
Ilya Leenson
DEFINICIJA
Hlor- sedamnaesti element periodnog sistema. Oznaka - Cl od latinskog "klorum". Smješten u trećem periodu, VIIA grupa. Odnosi se na nemetale. Nuklearni naboj je 17.
Najvažnije prirodno jedinjenje hlora je natrijum hlorid (kuhinjska so) NaCl. Glavna masa natrijum hlorida nalazi se u vodi mora i okeana. Vode mnogih jezera takođe sadrže značajne količine NaCl. Nalazi se i u čvrstom obliku, formirajući na mjestima u zemljinoj kori debele slojeve takozvane kamene soli. Druga jedinjenja hlora su takođe česta u prirodi, na primer kalijum hlorid u obliku minerala karnalit KCl × MgCl 2 × 6H 2 O i silvit KCl.
U normalnim uslovima, hlor je žuto-zeleni gas (slika 1), koji je veoma rastvorljiv u vodi. Kada se ohlade, kristalni hidrati se oslobađaju iz vodenih rastvora, koji su klarati približnog sastava Cl 2 × 6H 2 O i Cl 2 × 8H 2 O.
Rice. 1. Hlor u tečnom stanju. Izgled.
Atomska i molekulska masa hlora
Relativna atomska masa elementa je omjer mase atoma datog elementa i 1/12 mase atoma ugljika. Relativna atomska masa je bezdimenzionalna i označava se sa A r (indeks “r” je početno slovo engleske riječi relativno, što znači “relativan”). Relativna atomska masa atomskog hlora je 35.457 amu.
Mase molekula, kao i mase atoma, izražene su u jedinicama atomske mase. Molekularna masa supstance je masa molekula, izražena u jedinicama atomske mase. Relativna molekulska masa supstance je omjer mase molekula date supstance i 1/12 mase atoma ugljika, čija je masa 12 amu. Poznato je da je molekul hlora dvoatomski - Cl 2. Relativna molekulska težina molekula hlora bit će jednaka:
M r (Cl 2) = 35,457 × 2 ≈ 71.
Izotopi hlora
Poznato je da se u prirodi hlor može naći u obliku dva stabilna izotopa 35 Cl (75,78%) i 37 Cl (24,22%). Njihovi maseni brojevi su 35, odnosno 37. Jezgro atoma izotopa hlora 35 Cl sadrži sedamnaest protona i osamnaest neutrona, a izotop 37 Cl sadrži isti broj protona i dvadeset neutrona.
Postoje umjetni izotopi hlora s masenim brojevima od 35 do 43, među kojima je najstabilniji 36 Cl s vremenom poluraspada od 301 hiljadu godina.
Joni hlora
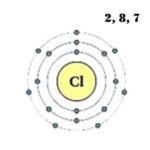
Vanjski energetski nivo atoma hlora ima sedam elektrona, koji su valentni elektroni:
1s 2 2s 2 2p 6 3s 2 3p 5 .
Kao rezultat hemijske interakcije, hlor može izgubiti svoje valentne elektrone, tj. budu njihov donor, i pretvaraju se u pozitivno nabijene jone ili prihvataju elektrone od drugog atoma, tj. budu njihov akceptor i pretvaraju se u negativno nabijene jone:
Cl 0 -7e → Cl 7+ ;
Cl 0 -5e → Cl 5+ ;
Cl 0 -4e → Cl 4+ ;
Cl 0 -3e → Cl 3+ ;
Cl 0 -2e → Cl 2+ ;
Cl 0 -1e → Cl 1+ ;
Cl 0 +1e → Cl 1- .
Molekula i atom hlora
Molekul hlora se sastoji od dva atoma - Cl 2. Evo nekih svojstava koja karakteriziraju atom i molekulu klora:
Primjeri rješavanja problema
PRIMJER 1
| Vježbajte | Koju zapreminu hlora treba uzeti da bi reagovao sa 10 litara vodonika? Gasovi su pod istim uslovima. |
| Rješenje | Napišimo jednačinu za reakciju između hlora i vodika: Cl 2 + H 2 = 2HCl. Izračunajmo količinu vodikove supstance koja je reagovala: n (H 2) = V (H 2) / V m; n (H 2) = 10 / 22,4 = 0,45 mol. Prema jednadžbi, n (H 2) = n (Cl 2) = 0,45 mol. Tada je zapremina hlora koji je reagovao sa vodonikom jednaka: |
Razmatraju se fizička svojstva hlora: gustina hlora, njegova toplotna provodljivost, specifična toplota i dinamički viskozitet pri različitim temperaturama. Fizička svojstva Cl 2 prikazana su u obliku tabela za tečno, čvrsto i gasovito stanje ovog halogena.
Osnovna fizička svojstva hlora
Hlor je uključen u VII grupu trećeg perioda periodnog sistema elemenata pod brojem 17. Pripada podgrupi halogena, ima relativnu atomsku i molekulsku masu od 35,453 odnosno 70,906. Na temperaturama iznad -30°C, hlor je zelenkasto-žuti gas sa karakterističnim jakim, iritirajućim mirisom. Lako se ukapljuje pod normalnim pritiskom (1,013·10 5 Pa) kada se ohladi na -34°C, i formira bistru tečnost boje ćilibara koja se stvrdnjava na -101°C.
Zbog svoje visoke hemijske aktivnosti, slobodni hlor se ne pojavljuje u prirodi, već postoji samo u obliku jedinjenja. Nalazi se uglavnom u mineralu halitu (), a također je dio minerala kao što su silvit (KCl), karnalit (KCl MgCl 2 6H 2 O) i silvinit (KCl NaCl). Sadržaj hlora u zemljinoj kori približava se 0,02% od ukupnog broja atoma zemljine kore, gde se nalazi u obliku dva izotopa 35 Cl i 37 Cl u procentualnom odnosu od 75,77% 35 Cl i 24,23% 37 Cl .
| Nekretnina | Značenje |
|---|---|
| Tačka topljenja, °C | -100,5 |
| Tačka ključanja, °C | -30,04 |
| Kritična temperatura, °C | 144 |
| Kritični pritisak, Pa | 77,1 10 5 |
| Kritična gustina, kg/m 3 | 573 |
| Gustina gasa (na 0°C i 1,013 10 5 Pa), kg/m 3 | 3,214 |
| Gustina zasićene pare (na 0°C i 3.664 10 5 Pa), kg/m 3 | 12,08 |
| Gustina tečnog hlora (na 0°C i 3.664 10 5 Pa), kg/m 3 | 1468 |
| Gustina tečnog hlora (na 15,6°C i 6,08 10 5 Pa), kg/m 3 | 1422 |
| Gustina čvrstog hlora (na -102°C), kg/m 3 | 1900 |
| Relativna gustina gasa u vazduhu (na 0°C i 1,013 10 5 Pa) | 2,482 |
| Relativna gustina zasićene pare u vazduhu (na 0°C i 3,664 10 5 Pa) | 9,337 |
| Relativna gustina tečnog hlora na 0°C (u odnosu na vodu na 4°C) | 1,468 |
| Specifična zapremina gasa (na 0°C i 1,013 10 5 Pa), m 3 /kg | 0,3116 |
| Specifična zapremina zasićene pare (na 0°C i 3.664 10 5 Pa), m 3 /kg | 0,0828 |
| Specifična zapremina tečnog hlora (na 0°C i 3.664 10 5 Pa), m 3 /kg | 0,00068 |
| Pritisak pare hlora na 0°C, Pa | 3.664 10 5 |
| Dinamički viskozitet gasa na 20°C, 10 -3 Pa s | 0,013 |
| Dinamički viskozitet tečnog hlora na 20°C, 10 -3 Pa s | 0,345 |
| Toplota fuzije čvrstog hlora (na tački topljenja), kJ/kg | 90,3 |
| Toplota isparavanja (na tački ključanja), kJ/kg | 288 |
| Toplota sublimacije (na tački topljenja), kJ/mol | 29,16 |
| Molarni toplotni kapacitet C p gasa (na -73…5727°C), J/(mol K) | 31,7…40,6 |
| Molarni toplotni kapacitet C p tečnog hlora (na -101…-34°C), J/(mol K) | 67,1…65,7 |
| Koeficijent toplotne provodljivosti gasa na 0°C, W/(m K) | 0,008 |
| Koeficijent toplotne provodljivosti tečnog hlora na 30°C, W/(m K) | 0,62 |
| Entalpija gasa, kJ/kg | 1,377 |
| Entalpija zasićene pare, kJ/kg | 1,306 |
| Entalpija tečnog hlora, kJ/kg | 0,879 |
| Indeks loma na 14°C | 1,367 |
| Specifična električna provodljivost na -70°S, S/m | 10 -18 |
| Elektronski afinitet, kJ/mol | 357 |
| Energija jonizacije, kJ/mol | 1260 |
Gustina hlora
U normalnim uslovima, hlor je težak gas sa približno 2,5 puta većom gustinom. Gustina gasovitog i tečnog hlora u normalnim uslovima (na 0°C) jednaka je 3,214 i 1468 kg/m3, respektivno. Kada se tečni ili plinoviti klor zagrijava, njegova gustoća se smanjuje zbog povećanja volumena zbog toplinskog širenja.
Gustina gasovitog hlora
U tabeli je prikazana gustina hlora u gasovitom stanju pri različitim temperaturama (u rasponu od -30 do 140°C) i normalnom atmosferskom pritisku (1,013·10 5 Pa). Gustoća hlora se mijenja s temperaturom - smanjuje se pri zagrijavanju. Na primjer, na 20°C gustina hlora je 2,985 kg/m3, a kada se temperatura ovog plina poveća na 100°C, vrijednost gustine se smanjuje na vrijednost od 2,328 kg/m 3.
| t, °S | ρ, kg/m 3 | t, °S | ρ, kg/m 3 |
|---|---|---|---|
| -30 | 3,722 | 60 | 2,616 |
| -20 | 3,502 | 70 | 2,538 |
| -10 | 3,347 | 80 | 2,464 |
| 0 | 3,214 | 90 | 2,394 |
| 10 | 3,095 | 100 | 2,328 |
| 20 | 2,985 | 110 | 2,266 |
| 30 | 2,884 | 120 | 2,207 |
| 40 | 2,789 | 130 | 2,15 |
| 50 | 2,7 | 140 | 2,097 |
Kako pritisak raste, gustina hlora se povećava. U donjoj tabeli prikazana je gustina gasovitog hlora u temperaturnom opsegu od -40 do 140°C i pritisku od 26,6·10 5 do 213·10 5 Pa. Sa povećanjem pritiska, proporcionalno se povećava gustina hlora u gasovitom stanju. Na primjer, povećanje pritiska hlora sa 53,2·10 5 na 106,4·10 5 Pa na temperaturi od 10°C dovodi do dvostrukog povećanja gustine ovog gasa.
| ↓ t, °S | P, kPa → | 26,6 | 53,2 | 79,8 | 101,3 |
|---|---|---|---|---|
| -40 | 0,9819 | 1,996 | — | — |
| -30 | 0,9402 | 1,896 | 2,885 | 3,722 |
| -20 | 0,9024 | 1,815 | 2,743 | 3,502 |
| -10 | 0,8678 | 1,743 | 2,629 | 3,347 |
| 0 | 0,8358 | 1,678 | 2,528 | 3,214 |
| 10 | 0,8061 | 1,618 | 2,435 | 3,095 |
| 20 | 0,7783 | 1,563 | 2,35 | 2,985 |
| 30 | 0,7524 | 1,509 | 2,271 | 2,884 |
| 40 | 0,7282 | 1,46 | 2,197 | 2,789 |
| 50 | 0,7055 | 1,415 | 2,127 | 2,7 |
| 60 | 0,6842 | 1,371 | 2,062 | 2,616 |
| 70 | 0,6641 | 1,331 | 2 | 2,538 |
| 80 | 0,6451 | 1,292 | 1,942 | 2,464 |
| 90 | 0,6272 | 1,256 | 1,888 | 2,394 |
| 100 | 0,6103 | 1,222 | 1,836 | 2,328 |
| 110 | 0,5943 | 1,19 | 1,787 | 2,266 |
| 120 | 0,579 | 1,159 | 1,741 | 2,207 |
| 130 | 0,5646 | 1,13 | 1,697 | 2,15 |
| 140 | 0,5508 | 1,102 | 1,655 | 2,097 |
| ↓ t, °S | P, kPa → | 133 | 160 | 186 | 213 |
|---|---|---|---|---|
| -20 | 4,695 | 5,768 | — | — |
| -10 | 4,446 | 5,389 | 6,366 | 7,389 |
| 0 | 4,255 | 5,138 | 6,036 | 6,954 |
| 10 | 4,092 | 4,933 | 5,783 | 6,645 |
| 20 | 3,945 | 4,751 | 5,565 | 6,385 |
| 30 | 3,809 | 4,585 | 5,367 | 6,154 |
| 40 | 3,682 | 4,431 | 5,184 | 5,942 |
| 50 | 3,563 | 4,287 | 5,014 | 5,745 |
| 60 | 3,452 | 4,151 | 4,855 | 5,561 |
| 70 | 3,347 | 4,025 | 4,705 | 5,388 |
| 80 | 3,248 | 3,905 | 4,564 | 5,225 |
| 90 | 3,156 | 3,793 | 4,432 | 5,073 |
| 100 | 3,068 | 3,687 | 4,307 | 4,929 |
| 110 | 2,985 | 3,587 | 4,189 | 4,793 |
| 120 | 2,907 | 3,492 | 4,078 | 4,665 |
| 130 | 2,832 | 3,397 | 3,972 | 4,543 |
| 140 | 2,761 | 3,319 | 3,87 | 4,426 |
Gustina tečnog hlora
Tečni hlor može postojati u relativno uskom temperaturnom rasponu, čije granice leže od minus 100,5 do plus 144 ° C (odnosno od tačke topljenja do kritične temperature). Iznad temperature od 144°C, hlor neće preći u tečno stanje ni pod kakvim pritiskom. Gustina tečnog hlora u ovom temperaturnom opsegu varira od 1717 do 573 kg/m3.
| t, °S | ρ, kg/m 3 | t, °S | ρ, kg/m 3 |
|---|---|---|---|
| -100 | 1717 | 30 | 1377 |
| -90 | 1694 | 40 | 1344 |
| -80 | 1673 | 50 | 1310 |
| -70 | 1646 | 60 | 1275 |
| -60 | 1622 | 70 | 1240 |
| -50 | 1598 | 80 | 1199 |
| -40 | 1574 | 90 | 1156 |
| -30 | 1550 | 100 | 1109 |
| -20 | 1524 | 110 | 1059 |
| -10 | 1496 | 120 | 998 |
| 0 | 1468 | 130 | 920 |
| 10 | 1438 | 140 | 750 |
| 20 | 1408 | 144 | 573 |
Specifični toplotni kapacitet hlora
Specifični toplotni kapacitet gasovitog hlora C p u kJ/(kg K) u temperaturnom opsegu od 0 do 1200°C i normalnom atmosferskom pritisku može se izračunati pomoću formule:
gdje je T apsolutna temperatura hlora u stepenima Kelvina.
Treba napomenuti da u normalnim uslovima specifični toplotni kapacitet hlora iznosi 471 J/(kg K) i raste kada se zagreva. Povećanje toplotnog kapaciteta na temperaturama iznad 500°C postaje neznatno, a pri visokim temperaturama specifična toplota hlora ostaje praktično nepromenjena.
U tabeli su prikazani rezultati proračuna specifične toplote hlora po gornjoj formuli (greška proračuna je oko 1%).
| t, °S | C p , J/(kg K) | t, °S | C p , J/(kg K) |
|---|---|---|---|
| 0 | 471 | 250 | 506 |
| 10 | 474 | 300 | 508 |
| 20 | 477 | 350 | 510 |
| 30 | 480 | 400 | 511 |
| 40 | 482 | 450 | 512 |
| 50 | 485 | 500 | 513 |
| 60 | 487 | 550 | 514 |
| 70 | 488 | 600 | 514 |
| 80 | 490 | 650 | 515 |
| 90 | 492 | 700 | 515 |
| 100 | 493 | 750 | 515 |
| 110 | 494 | 800 | 516 |
| 120 | 496 | 850 | 516 |
| 130 | 497 | 900 | 516 |
| 140 | 498 | 950 | 516 |
| 150 | 499 | 1000 | 517 |
| 200 | 503 | 1100 | 517 |
Na temperaturama blizu apsolutne nule, hlor je u čvrstom stanju i ima mali specifični toplotni kapacitet (19 J/(kg K)). Kako temperatura čvrstog Cl 2 raste, njegov toplotni kapacitet raste i dostiže vrijednost od 720 J/(kg K) na minus 143°C.
Tečni hlor ima specifični toplotni kapacitet od 918...949 J/(kg K) u opsegu od 0 do -90 stepeni Celzijusa. Prema tabeli, može se vidjeti da je specifični toplinski kapacitet tekućeg hlora veći od toplotnog kapaciteta gasovitog hlora i opada sa porastom temperature.
Toplotna provodljivost hlora
U tabeli su prikazane vrijednosti koeficijenata toplinske provodljivosti plinovitog klora pri normalnom atmosferskom tlaku u temperaturnom rasponu od -70 do 400°C.
Koeficijent toplotne provodljivosti hlora u normalnim uslovima je 0,0079 W/(m deg), što je 3 puta manje nego pri istoj temperaturi i pritisku. Zagrijavanje hlora dovodi do povećanja njegove toplinske provodljivosti. Dakle, na temperaturi od 100°C, vrijednost ovog fizičkog svojstva hlora raste na 0,0114 W/(m deg).
| t, °S | λ, W/(m stepeni) | t, °S | λ, W/(m stepeni) |
|---|---|---|---|
| -70 | 0,0054 | 50 | 0,0096 |
| -60 | 0,0058 | 60 | 0,01 |
| -50 | 0,0062 | 70 | 0,0104 |
| -40 | 0,0065 | 80 | 0,0107 |
| -30 | 0,0068 | 90 | 0,0111 |
| -20 | 0,0072 | 100 | 0,0114 |
| -10 | 0,0076 | 150 | 0,0133 |
| 0 | 0,0079 | 200 | 0,0149 |
| 10 | 0,0082 | 250 | 0,0165 |
| 20 | 0,0086 | 300 | 0,018 |
| 30 | 0,009 | 350 | 0,0195 |
| 40 | 0,0093 | 400 | 0,0207 |
Viskozitet hlora
Koeficijent dinamičke viskoznosti gasovitog hlora u temperaturnom opsegu 20...500°C može se približno izračunati pomoću formule:
gdje je η T koeficijent dinamičke viskoznosti hlora na datoj temperaturi T, K;
η T 0 - koeficijent dinamičke viskoznosti hlora na temperaturi T 0 = 273 K (pri normalnim uslovima);
C je Sutherlandova konstanta (za klor C = 351).
U normalnim uslovima, dinamički viskozitet hlora je 0,0123·10 -3 Pa·s. Kada se zagrije, fizička svojstva hlora, kao što je viskoznost, poprima veće vrijednosti.
Tečni hlor ima viskozitet za red veličine veći od gasovitog hlora. Na primjer, na temperaturi od 20°C, dinamički viskozitet tekućeg hlora ima vrijednost od 0,345·10 -3 Pa·s i opada s porastom temperature.
Izvori:
- Barkov S. A. Halogeni i podgrupa mangana. Elementi grupe VII periodnog sistema D. I. Mendeljejeva. Priručnik za studente. M.: Obrazovanje, 1976 - 112 str.
- Tabele fizičkih veličina. Imenik. Ed. akad. I. K. Kikoina. M.: Atomizdat, 1976 - 1008 str.
- Yakimenko L. M., Pasmanik M. I. Priručnik o proizvodnji hlora, kaustične sode i osnovnih proizvoda hlora. Ed. 2., per. i dr. M.: Hemija, 1976 - 440 str.
Klor je prvi put dobio 1772. godine od strane Scheelea, koji je opisao njegovo oslobađanje tokom interakcije piroluzita sa hlorovodoničnom kiselinom u svojoj raspravi o piroluzitu: 4HCl + MnO 2 = Cl 2 + MnCl 2 + 2H 2 O
Šele je primetio miris hlora, sličan mirisu carske vode, njegovu sposobnost da reaguje sa zlatom i cinoberom i svojstva izbeljivanja. Međutim, Scheele je, u skladu sa teorijom flogistona koja je tada bila dominantna u hemiji, sugerirao da je hlor deflogisticirana hlorovodonična kiselina, odnosno oksid hlorovodonične kiseline.
Berthollet i Lavoisier su sugerirali da je hlor oksid elementa muria, ali pokušaji da se izoluju ostali su neuspješni sve do Davyjevog rada, koji je uspio elektrolizom razgraditi kuhinjsku sol u natrijum i hlor.
Naziv elementa dolazi iz grčkog clwroz- "zeleno".
Boravak u prirodi, primanje:
Prirodni hlor je mješavina dva izotopa 35 Cl i 37 Cl. U zemljinoj kori, hlor je najčešći halogen. Pošto je hlor veoma aktivan, u prirodi se nalazi samo u obliku jedinjenja u mineralima: halit NaCl, silvit KCl, silvinit KCl NaCl, bišofit MgCl 2 6H 2 O, karnalit KCl MgCl 2 6H 2 O, kainit KCl MgSO4 ·3H 2 O. Najveće rezerve hlora sadržane su u solima voda mora i okeana.
U industrijskim razmjerima, klor se proizvodi zajedno s natrijevim hidroksidom i vodikom elektrolizom otopine kuhinjske soli:
2NaCl + 2H 2 O => H 2 + Cl 2 + 2NaOH
Za regeneraciju hlora iz hlorovodonika, koji je nusproizvod tokom industrijskog hlorisanja organskih jedinjenja, koristi se Deacon proces (katalitička oksidacija hlorovodonika sa atmosferskim kiseonikom):
4HCl + O 2 = 2H 2 O + 2Cl 2
Procesi koji se obično koriste u laboratorijama zasnivaju se na oksidaciji hlorovodonika jakim oksidantima (na primjer, mangan (IV) oksid, kalijum permanganat, kalijev dihromat):
2KMnO 4 + 16HCl = 5Cl 2 + 2MnCl 2 + 2KCl +8H 2 O
K 2 Cr 2 O 7 + 14HCl = 3Cl 2 + 2CrCl 3 + 2KCl + 7H 2 O
Fizička svojstva:
U normalnim uslovima, hlor je žuto-zeleni gas sa zagušljivim mirisom. Hlor je značajno rastvorljiv u vodi („hlorna voda“). Na 20°C, 2,3 zapremine hlora se rastvori u jednoj zapremini vode. Tačka ključanja = -34°C; tačka topljenja = -101°C, gustina (gas, n.s.) = 3,214 g/l.
Hemijska svojstva:
Klor je vrlo aktivan - direktno se kombinira sa gotovo svim elementima periodnog sistema, metalima i nemetalima (osim ugljika, dušika, kisika i inertnih plinova). Klor je vrlo jak oksidant, koji istiskuje manje aktivne nemetale (brom, jod) iz njihovih spojeva sa vodikom i metalima:
Cl 2 + 2HBr = Br 2 + 2HCl; Cl 2 + 2NaI = I 2 + 2NaCl
Kada se rastvori u vodi ili lužinama, hlor dismutira, formirajući hipohlornu (a kada se zagrije, perhlornu) i hlorovodoničnu kiselinu ili njihove soli.
Cl 2 + H 2 O HClO + HCl;
Klor stupa u interakciju s mnogim organskim spojevima, ulazeći u reakcije supstitucije ili adicije:
CH 3 -CH 3 + xCl 2 => C 2 H 6-x Cl x + xHCl
CH 2 =CH 2 + Cl 2 => Cl-CH 2 -CH 2 -Cl
C 6 H 6 + Cl 2 => C 6 H 6 Cl + HCl
Hlor ima sedam oksidacionih stanja: -1, 0, +1, +3, +4, +5, +7.
Najvažnije veze:
Hlorovodonik HCl- bezbojni plin koji se dimi u zraku zbog stvaranja kapljica magle sa vodenom parom. Ima oštar miris i jako iritira respiratorni trakt. Sadrži u vulkanskim gasovima i vodama, u želudačnom soku. Hemijska svojstva zavise od toga u kom se stanju nalazi (može biti u gasovitom, tečnom ili rastvorenom stanju). Rastvor HCl se naziva hlorovodonične kiseline. To je jaka kiselina i istiskuje slabije kiseline iz njihovih soli. soli - hloridi- čvrste kristalne supstance sa visokim tačkama topljenja.
Kovalentni hloridi- jedinjenja hlora sa nemetalima, gasovima, tečnostima ili topljivim čvrstim materijama koje imaju karakteristična kisela svojstva, obično se lako hidroliziraju vodom u hlorovodoničnu kiselinu:
PCl 5 + 4H 2 O = H 3 PO 4 + 5HCl;
Klor(I) oksid Cl 2 O., gas smeđe-žute boje sa oštrim mirisom. Utiče na respiratorne organe. Lako se rastvara u vodi, stvarajući hipohlornu kiselinu.
Hipohlorna kiselina HClO. Postoji samo u rješenjima. To je slaba i nestabilna kiselina. Lako se razlaže na hlorovodoničnu kiselinu i kiseonik. Jako oksidaciono sredstvo. Nastaje kada se hlor otopi u vodi. soli - hipohloritima, niska stabilnost (NaClO*H 2 O se eksplozivno raspada na 70 °C), jaki oksidanti. Široko se koristi za izbjeljivanje i dezinfekciju prah za izbjeljivanje, miješana sol Ca(Cl)OCl
Hlorna kiselina HClO 2, u slobodnom obliku je nestabilan, čak se i u razrijeđenoj vodenoj otopini brzo raspada. Kiselina srednje jačine, soli - hloritima, u pravilu su bezbojni i vrlo topljivi u vodi. Za razliku od hipohlorita, hloriti pokazuju izražena oksidaciona svojstva samo u kiseloj sredini. Najveća upotreba (za izbjeljivanje tkanina i papirne pulpe) je natrijum hlorit NaClO 2.
Klor(IV) oksid ClO 2, je zelenkasto-žuti gas neprijatnog (oporog) mirisa, ...
Hlorna kiselina, HClO 3 - u slobodnom obliku je nestabilan: nesrazmjeran je u ClO 2 i HClO 4. soli - hlorati; Od njih su najvažniji natrijum, kalijum, kalcijum i magnezijum hlorati. To su jaki oksidanti i eksplozivni su kada se pomiješaju sa redukcijskim agensima. kalijum hlorat ( Bertoletova so) - KClO 3, korišćen je za proizvodnju kiseonika u laboratoriji, ali se zbog velike opasnosti više nije koristio. Rastvori kalijum hlorata korišćeni su kao slab antiseptik i spoljno lekovito ispiranje grla.
Perhlorna kiselina HClO 4, u vodenim rastvorima, perhlorna kiselina je najstabilnija od svih hlornih kiselina koje sadrže kiseonik. Bezvodna perhlorna kiselina, koja se dobija koncentrovanom sumpornom kiselinom od 72% HClO 4, nije vrlo stabilna. To je najjača monoprotinska kiselina (u vodenom rastvoru). soli - perhlorati, koriste se kao oksidanti (raketni motori na čvrsto gorivo).
primjena:
Klor se koristi u mnogim industrijama, nauci i kućnim potrebama:
- U proizvodnji polivinil hlorida, plastičnih jedinjenja, sintetičke gume;
- Za izbjeljivanje tkanine i papira;
- Proizvodnja organohlornih insekticida - supstanci koje ubijaju insekte štetne za useve, ali su bezbedne za biljke;
- Za dezinfekciju vode - “hlorisanje”;
- Registrovan u prehrambenoj industriji kao aditiv za hranu E925;
- U hemijskoj proizvodnji hlorovodonične kiseline, izbeljivača, bertolet soli, metalnih hlorida, otrova, lekova, đubriva;
- U metalurgiji za proizvodnju čistih metala: titanijum, kalaj, tantal, niobijum.
Biološka uloga i toksičnost:
Klor je jedan od najvažnijih biogenih elemenata i dio je svih živih organizama. Kod životinja i ljudi, joni hlora sudjeluju u održavanju osmotske ravnoteže; kloridni ion ima optimalan radijus za prodiranje kroz ćelijsku membranu. Joni hlora su vitalni za biljke, učestvuju u energetskom metabolizmu u biljkama, aktiviraju oksidativnu fosforilaciju.
Klor u obliku jednostavne supstance je otrovan, ako uđe u pluća, izaziva opekotine plućnog tkiva i gušenje. Deluje iritativno na respiratorni trakt u koncentraciji u vazduhu od oko 0,006 mg/l (tj. dvostruko iznad praga za percepciju mirisa hlora). Hlor je bio jedan od prvih hemijskih agenasa koje je Nemačka upotrebila u Prvom svetskom ratu.
Korotkova Yu., Shvetsova I.
HF Tjumenski državni univerzitet, 571 grupa.
Izvori: Wikipedia: http://ru.wikipedia.org/wiki/Cl, itd.,
Web stranica Ruskog hemijsko-tehničkog univerziteta po imenu. D.I. Mendeljejev:
Karakteristike elemenata VII grupe glavne podgrupe, na primjeru hlora
Opće karakteristike podgrupe
Tabela 1. Nomenklatura elemenata podgrupe VIIA
P-elementi, tipični, nemetali (astatin je polumetal), halogeni.
Elektronski dijagram elementa Hal (Hal ≠ F):
Elemente podgrupe VIIA karakteriziraju sljedeće valencije:
Tabela 2. Valencija
3. Elemente podgrupe VIIA karakterišu sledeća oksidaciona stanja:
Tabela 3. Oksidacijska stanja elemenata
Karakteristike hemijskog elementa
Hlor je element grupe VII A. Serijski broj 17
Relativna atomska masa: 35,4527 a. e.m. (g/mol)
 Broj protona, neutrona, elektrona: 17,18,17
Broj protona, neutrona, elektrona: 17,18,17
Atomska struktura:
![]()
Elektronska formula:
Tipična oksidaciona stanja: -1, 0, +1, +3, +4, +5, +7
Energija jonizacije: 1254,9(13,01) kJ/mol (eV)
Elektronski afinitet: 349 (kJ/mol)
Elektronegativnost prema Paulingu: 3.20
Karakteristike jednostavne supstance
Vrsta veze: kovalentna nepolarna
Dvoatomski molekul
Izotopi: 35 Cl (75,78%) i 37 Cl (24,22%)
Tip kristalne rešetke: molekularna
Termodinamički parametri
Tabela 4
Fizička svojstva
Tabela 5
Hemijska svojstva
Vodeni rastvor hlora je visoko dismutiran („hlorna voda“)
Faza 1: Cl 2 + H 2 O = HCl + HOCl
Faza 2: HOCl = HCl + [O] – atomski kiseonik
Oksidacijski kapacitet u podgrupi opada od fluora do joda = ˃
Klor je jako oksidaciono sredstvo:
1. Interakcija sa jednostavnim supstancama
a) sa vodonikom:
Cl 2 + H 2 = 2HCl
b) sa metalima:
Cl 2 + 2Na = 2NaCl
3Cl 2 + 2Fe = 2FeCl 3
c) s nekim manje elektronegativnim nemetalima:
3Cl 2 + 2P = 2PCl 3
Cl 2 + S = SCl 2
Sa kiseonikom, ugljenikom i azotom, hlor direktno ne reaguje!
2. Interakcija sa složenim supstancama
a) sa vodom: vidi gore
b) sa kiselinama: ne reaguje!
c) sa alkalnim rastvorima:
na hladnom: Cl 2 +2 NaOH = NaCl + NaClO + H 2 O
kada se zagrije: 3Cl 2 + 6 KOH = 5KCl + KClO 3 + 3H 2 O
e) sa mnogim organskim materijama:
Cl 2 + CH 4 = CH 3 Cl + HCl
C 6 H 6 + Cl 2 = C 6 H 5 Cl + HCl
Najvažnija jedinjenja hlora
 Hlorovodonik, hlorovodonik(HCl) je bezbojan, termički stabilan gas (u normalnim uslovima) oštrog mirisa, isparenja u vlažnom vazduhu, lako se rastvara u vodi (do 500 zapremina gasa po zapremini vode) da bi formirao hlorovodoničnu (hlorovodoničnu) kiselinu. Na -114,22 °C, HCl prelazi u čvrsto stanje. U čvrstom stanju, hlorovodonik postoji u obliku dve kristalne modifikacije: ortorombne, stabilne ispod i kubične.
Hlorovodonik, hlorovodonik(HCl) je bezbojan, termički stabilan gas (u normalnim uslovima) oštrog mirisa, isparenja u vlažnom vazduhu, lako se rastvara u vodi (do 500 zapremina gasa po zapremini vode) da bi formirao hlorovodoničnu (hlorovodoničnu) kiselinu. Na -114,22 °C, HCl prelazi u čvrsto stanje. U čvrstom stanju, hlorovodonik postoji u obliku dve kristalne modifikacije: ortorombne, stabilne ispod i kubične.
Vodena otopina klorovodika naziva se hlorovodonična kiselina. Kada se rastvori u vodi, dešavaju se sljedeći procesi:
HCl g + H 2 O l = H 3 O + l + Cl − l
Proces rastvaranja je vrlo egzoterman. Sa vodom HCl formira azeotropnu smjesu. To je jaka monoprotična kiselina. Energetski reaguje sa svim metalima u naponskom nizu levo od vodonika, sa bazičnim i amfoternim oksidima, bazama i solima, formirajući soli - hloridi:
Mg + 2 HCl → MgCl 2 + H 2
FeO + 2 HCl → FeCl 2 + H 2 O
Kada je izložen jakim oksidantima ili tokom elektrolize, hlorovodonik pokazuje redukciona svojstva:
MnO 2 + 4 HCl → MnCl 2 + Cl 2 + 2 H 2 O
Kada se zagrije, hlorovodonik se oksidira kiseonikom (katalizator - bakar(II) hlorid CuCl 2):
4 HCl + O 2 → 2 H 2 O +2 Cl 2
Međutim, koncentrirana hlorovodonična kiselina reaguje sa bakrom da formira monovalentni kompleks bakra:
2 Cu + 4 HCl → 2 H + H 2
Mješavina od 3 volumna dijela koncentrirane hlorovodonične kiseline i 1 volumnog dijela koncentrirane dušične kiseline naziva se "kraljevska voda". Aqua regia može čak rastvoriti zlato i platinu. Visoka oksidativna aktivnost aqua regia je zbog prisustva nitrozil hlorida i hlora u njoj, koji su u ravnoteži sa polaznim supstancama:
4 H 3 O + + 3 Cl − + NO 3 − = NOCl + Cl 2 + 6 H 2 O
Zbog visoke koncentracije kloridnih jona u otopini, metal se veže u hloridni kompleks, što potiče njegovo otapanje:
3 Pt + 4 HNO 3 + 18 HCl → 3 H 2 + 4 NO + 8 H 2 O
Klorovodik također karakteriziraju reakcije adicije na višestruke veze (elektrofilna adicija):
R-CH=CH 2 + HCl → R-CHCl-CH 3
R-C≡CH + 2 HCl → R-CCl 2 -CH 3
Oksidi hlora- neorganska hemijska jedinjenja hlora i kiseonika, sa opštom formulom: Cl x O y.
Hlor stvara sledeće okside: Cl 2 O, Cl 2 O 3, ClO 2, Cl 2 O 4, Cl 2 O 6, Cl 2 O 7. Osim toga, poznati su: kratkotrajni radikal ClO, radikal hlor peroksida ClOO i radikal hlor tetroksida ClO 4 .
Donja tabela prikazuje svojstva stabilnih hlornih oksida:
Tabela 6
| Nekretnina | Cl2O | ClO2 | ClOClO 3 | Cl 2 O 6 (l)↔2ClO 3 (g) | Cl2O7 |
| Boja i stanje sobe. temperaturu | Žuto-smeđi gas | Žuto-zeleni gas | Svetlo žuta tečnost | Tamnocrvena tečnost | Bezbojna tečnost |
| Oksidacijsko stanje hlora | (+1) | (+4) | (+1), (+7) | (+6) | (+7) |
| T. pl., °C | −120,6 | −59 | −117 | 3,5 | −91,5 |
| Temperatura ključanja, °C | 2,0 | 44,5 | |||
| d(f, 0°C), g*cm -3 | - | 1,64 | 1,806 | - | 2,02 |
| ΔH° uzorak (gas, 298 K), kJ*mol -1 | 80,3 | 102,6 | ~180 | (155) | |
| ΔG° uzorak (gas, 298 K), kJ*mol -1 | 97,9 | 120,6 | - | - | - |
| S° uzorak (gas, 298 K), J*K -1 *mol -1 | 265,9 | 256,7 | 327,2 | - | - |
| Dipolni moment μ, D | 0,78 ± 0,08 | 1,78 ± 0,01 | - | - | 0,72 ± 0,02 |
 Klor oksid (I), Dihlor oksid, anhidrid hipohlorne kiseline - jedinjenje hlora u oksidacionom stanju +1 sa kiseonikom.
Klor oksid (I), Dihlor oksid, anhidrid hipohlorne kiseline - jedinjenje hlora u oksidacionom stanju +1 sa kiseonikom.
U normalnim uslovima, to je smeđe-žuti gas sa karakterističnim mirisom koji podseća na hlor. Na temperaturama ispod 2 °C tečnost je zlatnocrvene boje. Toksično: utiče na respiratorni trakt. Spontano se polako razgrađuje:
Eksplozivno u visokim koncentracijama. Gustina u normalnim uslovima je 3,22 kg/m³. Rastvara se u tetrahloridu ugljenika. Rastvorljiv u vodi stvarajući slabu hipohlornu kiselinu:
Brzo reaguje sa alkalijama:
Cl 2 O + 2NaOH (razd.) = 2NaClO + H 2 O
Klor dioksid- kiseli oksid. Pri otapanju u vodi nastaju kloridna i perhlorna kiselina (reakcija disproporcioniranja). Razrijeđene otopine su stabilne u mraku i polako se raspadaju na svjetlu:
 Klor dioksid- hlor oksid ( IV), spoj hlora i kiseonika, formula: ClO 2.
Klor dioksid- hlor oksid ( IV), spoj hlora i kiseonika, formula: ClO 2.
U normalnim uslovima, ClO 2 je crvenkasto-žuti gas sa karakterističnim mirisom. Na temperaturama ispod 10 °C ClO 2 je crveno-smeđa tečnost. Niska stabilnost, eksplodira na svjetlosti, u kontaktu sa oksidantima i kada se zagrije. Dobro rastvorimo u vodi. Zbog opasnosti od eksplozije, hlor dioksid se ne može skladištiti kao tečnost.
Kiseli oksid. Pri otapanju u vodi nastaju kloridna i perhlorna kiselina (reakcija disproporcioniranja). Razrijeđene otopine su stabilne u mraku i polako se raspadaju na svjetlu:
Nastala klorovita kiselina je vrlo nestabilna i razlaže se:
Pokazuje redoks svojstva.
2ClO 2 + 5H 2 SO 4 (razrijeđeno) + 10FeSO 4 = 5Fe 2 (SO 4) 3 + 2HCl + 4H 2 O
ClO 2 + 2NaOH hladno. = NaClO 2 + NaClO 3 + H 2 O
ClO 2 + O 3 = ClO 3 + O 2
ClO 2 reaguje sa mnogim organskim jedinjenjima i deluje kao oksidaciono sredstvo srednje jakosti.
 Hipohlorna kiselina- HClO, vrlo slaba monoprotinska kiselina u kojoj hlor ima oksidaciono stanje +1. Postoji samo u rješenjima.
Hipohlorna kiselina- HClO, vrlo slaba monoprotinska kiselina u kojoj hlor ima oksidaciono stanje +1. Postoji samo u rješenjima.
U vodenim rastvorima, hipohlorna kiselina se delimično raspada na proton i hipohloritni anion ClO − :
Nestabilno. Hipohlorna kiselina i njene soli - hipohloritima- jaki oksidanti. Reaguje sa hlorovodoničnom kiselinom HCl, formirajući molekularni hlor:
HClO + NaOH (razrijeđeno) = NaClO + H 2 O 
Hlorna kiselina- HClO 2, jednobazna kiselina srednje jačine.
Klorna kiselina HClO 2 u slobodnom obliku je nestabilna, čak i u razrijeđenoj vodenoj otopini brzo se razgrađuje:
Neutralisan alkalijama.
HClO 2 + NaOH (razm. hladno) = NaClO 2 + H 2 O
Anhidrid ove kiseline je nepoznat.
Od njegovih soli se priprema kiseli rastvor - hloritima nastaje kao rezultat interakcije ClO 2 sa alkalijama:
Pokazuje redoks svojstva.
5HClO2 + 3H2SO4 (razrijeđeno) + 2KMnO4 = 5HClO3 + 2MnSO4 + K2SO4 + 3H2O
 Hlorna kiselina- HClO 3, jaka jednobazna kiselina u kojoj hlor ima oksidaciono stanje +5. Nije primljeno u slobodnom obliku; u vodenim rastvorima pri koncentracijama ispod 30% na hladnom je prilično stabilan; u koncentriranijim otopinama se razgrađuje:
Hlorna kiselina- HClO 3, jaka jednobazna kiselina u kojoj hlor ima oksidaciono stanje +5. Nije primljeno u slobodnom obliku; u vodenim rastvorima pri koncentracijama ispod 30% na hladnom je prilično stabilan; u koncentriranijim otopinama se razgrađuje:
Hipohlorna kiselina je jako oksidaciono sredstvo; oksidacijski kapacitet raste s povećanjem koncentracije i temperature. HClO 3 se lako redukuje u hlorovodoničnu kiselinu:
HClO 3 + 5HCl (konc.) = 3Cl 2 + 3H 2 O
HClO 3 + NaOH (razrijeđen) = NaClO 3 + H 2 O
Kada se mješavina SO 2 i zraka prođe kroz jako kiselu otopinu, nastaje hlor dioksid:
U 40% perhlorne kiseline, filter papir se, na primjer, zapali.
8. Biti u prirodi:
U zemljinoj kori, hlor je najčešći halogen. Pošto je klor vrlo aktivan, u prirodi se javlja samo u obliku spojeva u mineralima.
Tabela 7. Nalaz u prirodi
Tabela 7. Mineralni oblici
Najveće rezerve hlora sadržane su u solima voda mora i okeana.
Potvrda
Hemijske metode za proizvodnju hlora su neefikasne i skupe. Danas imaju uglavnom istorijski značaj. Može se dobiti reakcijom kalijum permanganata sa hlorovodoničnom kiselinom:
Scheele metoda
U početku se industrijska metoda za proizvodnju klora temeljila na Scheele metodi, odnosno reakciji piroluzita sa klorovodičnom kiselinom:
Deacon Method
Metoda za proizvodnju hlora katalitičkom oksidacijom hlorovodonika sa atmosferskim kiseonikom.
Elektrohemijske metode
Danas se klor proizvodi u industrijskim razmjerima zajedno s natrijevim hidroksidom i vodikom elektrolizom otopine kuhinjske soli, čiji se glavni procesi mogu predstaviti zbirnom formulom:
Aplikacija
· Prozorski profil od polimera koji sadrže klor
· Glavna komponenta izbjeljivača je Labarraco voda (natrijum hipohlorit)
· U proizvodnji polivinil hlorida, plastičnih jedinjenja, sintetičke gume.
· Proizvodnja organohlornih kiselina. Značajan dio proizvedenog hlora se troši za dobijanje sredstava za zaštitu bilja. Jedan od najvažnijih insekticida je heksahlorocikloheksan (često se naziva heksahloran).
· Koristi se kao hemijsko ratno sredstvo, kao i za proizvodnju drugih hemijskih ratnih agenasa: iperit, fosgen.
· Za dezinfekciju vode - “hlorisanje”.
· Registrovan u prehrambenoj industriji kao aditiv za hranu E925.
· U hemijskoj proizvodnji hlorovodonične kiseline, izbeljivača, bertolet soli, metalnih hlorida, otrova, lekova, đubriva.
· U metalurgiji za proizvodnju čistih metala: titanijum, kalaj, tantal, niobijum.
· Kao indikator solarnih neutrina u detektorima hlor-argon.
Mnoge razvijene zemlje nastoje da ograniče upotrebu hlora u svakodnevnom životu, uključujući i zato što sagorevanje otpada koji sadrži hlor proizvodi značajnu količinu dioksina.