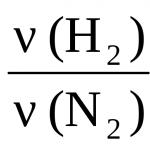Hemijski proračuni pomoću hemijskih jednačina. Izračunavanje mase tvari pomoću jednadžbe kemijske reakcije
Uz pomoć stehiometrijskih koeficijenata, shema kemijske reakcije pretvara se u njenu jednadžbu, koja eksplicitno odražava zakon održanja broja atoma svake vrste tokom prijelaza sa polaznih tvari (reagensa) na produkte reakcije.
Stehiometrijski koeficijenti nam omogućavaju da uspostavimo odnos između količina supstanci koje učestvuju u reakciji na osnovu sledećeg pravila:
koeficijenti u hemijskoj jednadžbi specificirajumolar proporcije (omjeri) u kojima početne tvari (reagensi) reagiraju i nastaju produkti reakcije.
Razmotrimo, kao primjer, reakciju sinteze amonijaka:
3H 2 + N 2 = 2NH 3,
za koje, prema gore navedenom pravilu, možemo pisati
gdje su indeksi “ex”. i "arr." odgovaraju količinama izreagovanih i formiranih supstanci. Posljednji odnos se može predstaviti u drugom obliku:
a) za supstance H 2 i N 2: 
ili u drugom obliku  ;
;
b) za supstance H 2 i NH 3:  ili
ili  ;
;
c) za supstance N 2 i NH 3:  ili
ili  .
.
Lako je vidjeti da se sve proporcije mogu kombinirati i napisati u obliku:
 =
= .
.
Posljednja jednakost je osnovna proračunska jednačina, povezujući količine izreagiranih supstanci i nastalih produkta reakcije. Ako je potrebno, mase i zapremine učesnika reakcije mogu se uvesti u ovu jednačinu iz uslova problema koristeći uobičajene odnose.
Na primjer, za reakciju
4FeS 2 (t) + 11O 2 = 2Fe 2 O 3 (t) + 8SO 2 (g)
glavna računska jednačina je:
i ako u njega unesemo mase koje se obično navode u problemima za čvrsta tijela i zapremine za plinove, tada će poprimiti sljedeći oblik:
Metoda kalkulacije korištenje osnovne projektne jednadžbe kemijske reakcije uključuje nekoliko općih točaka:
1) Prije svega, određuje se pomoćna supstanca, količina po kojoj se provode svi naredni proračuni. U opisu problema za njega je navedena ili masa, ili volumen, ili koncentracija, što vam zauzvrat omogućava izračunavanje broja molova potporne tvari. To po pravilu nije teško, ali izuzetak se odnosi na takozvane probleme viška i manjka, kada pomoćna supstanca potrebno je birati dva originalna.Činjenica je da se prilikom pripreme reakcione smjese početne tvari mogu miješati u bilo kojim omjerima, ali će uvijek reagirati jedna s drugom u strogo određenim omjerima, koji za njih uspostavljaju stehiometrijske koeficijente u jednadžbi kemijske reakcije. U tim uslovima sasvim je moguća situacija da jedna od polaznih supstanci potpuno reaguje, a deo druge ostane nereagovan i tada kažu da je prva supstanca uzeta u manjku u odnosu na drugu i, obrnuto, druga supstanca je u višku u odnosu na prvu. U tom slučaju, početnu tvar uzetu u nedostatku treba odabrati kao pomoćnu tvar, jer će njena količina odrediti kako završetak reakcije tako i količinu nastalih produkata.
Kako odrediti pomoćnu tvar ako problem sadrži podatke (masa, zapremina, itd.) za obje početne tvari? Neka reaguju dvije supstance A i B
aA + bB → produkti reakcije,
a početne količine ovih supstanci 0 (A) i 0 (B) mogu se izračunati iz uslova zadatka.
Da biste odgovorili na pitanje, potrebno je uporediti dva broja  , gdje su moguće tri opcije:
, gdje su moguće tri opcije:
I var.  , tada se početna reakcijska smjesa naziva stehiometrijska i bilo koja od njih - A ili B - može se odabrati kao noseća tvar;
, tada se početna reakcijska smjesa naziva stehiometrijska i bilo koja od njih - A ili B - može se odabrati kao noseća tvar;
II var.  , tada se supstanca A uzima u višku i supstanca B će biti pomoćna;
, tada se supstanca A uzima u višku i supstanca B će biti pomoćna;
III var.  , tada će supstanca B biti u višku, a supstanca A će biti pomoćna.
, tada će supstanca B biti u višku, a supstanca A će biti pomoćna.
Završetak ireverzibilnih hemijskih reakcija u prvoj varijanti nastaje u trenutku istovremenog nestanka obe polazne supstance, a u druge dve - u trenutku nestanka supstance uzete u nedostatku, iu konačnoj mešavini supstanci, zajedno sa produktima reakcije, postojat će neizreagirani ostatak tvari uzete u višku.
2) Iz glavne računske jednačine slijedi jednostavna pravilo za određivanje broja mladeža reagovane početne supstance i nastali produkti prema broju molova pomoćne supstance:
Da bi se odredio broj molova tvari koja je reagirala ili nastala u reakciji, potrebno je podijeliti broj molova referentne tvari sa njenim stehiometrijskim koeficijentom i pomnožiti ovaj rezultat sa stehiometrijskim koeficijentom tvari koja se utvrđuje.
Za reakciju 2Al + 6HCl = 2AlCl 3 + H 2 ,
gdje je noseća tvar, na primjer, aluminij, možemo napisati:



Nakon što smo odredili količine supstanci koje nas zanimaju, lako je izračunati njihove mase, zapremine i koncentracije, odnosno one karakteristike učesnika u hemijskoj reakciji koje se pojavljuju u formulaciji problema.
Dakle, opšta shema proračuna za jednadžbu hemijske reakcije može se predstaviti kao:
Nepovratna reakcija.
Neka  I
I  početne količine reagensa A i B i
početne količine reagensa A i B i  , tj. tada se supstanca A uzima u višku
, tj. tada se supstanca A uzima u višku
a A+ V B = With C + d D
|
(višak) |
(mana) | |||||
|
kraj reakcije: |
|
|
|
|||
Reverzibilna reakcija.
U ovom slučaju, reakcija se završava uspostavljanjem hemijske ravnoteže, a ravnotežna smeša sadrži i produkte reakcije i ostatak polaznih supstanci. Pretpostavimo da do trenutka kada se uspostavi ravnoteža, npr. X mol proizvoda C je, dakle, pomoćna supstanca
a A+ V B With C + d D
|
Početak reakcije: |
|
| ||
|
ravnoteža: |
|
|
|
|
Primjer 1. Rastvor koji sadrži 20,0 g natrijum hidroksida apsorbovao je 6,72 litara ugljen-dioksida (n.o.). Odredite produkte reakcije i njihove količine.
Kada alkalna otopina apsorbira kisele okside (CO 2 , SO 2 , P 2 O 5 itd.) ili jedinjenja vodonika (H 2 S itd.), koji odgovaraju višebaznim kiselinama, u prvoj fazi, sa viškom alkalija , uvijek nastaju srednje soli, koje se u drugoj fazi, u prisustvu viška apsorbiranog reagensa, djelomično ili potpuno pretvaraju u kisele soli:
CO 2 (gas) + 2 NaOH = Na 2 CO 3 + H 2 O
Preostali ugljični dioksid reagira s natrijevim karbonatom:
Na 2 CO 3 + CO 2 (gas) + H 2 O = 2 NaHCO 3
|
kraj reakcije: |
|
|
Dakle, otopina sadrži mješavinu soli: 0,1 mol NaHCO 3 i 0,2 mol Na 2 CO 3.
Primjer 2. U čašu sa 200 ml rastvora fosforne kiseline molarne koncentracije od 0,5 mol/l dodano je 6 g natrijum hidroksida. Odredite sastav otopine nakon završetka reakcije.
Prilikom neutralizacije višebaznih kiselina alkalijama (NaOH, KOH, NH 3 itd.), atomi vodika se sukcesivno zamjenjuju metalnom ili amonijskom grupom, a sastav produkta reakcije ovisi o omjeru količina reagensa. U našem slučaju, ako – nastaje NaH 2 PO 4; ako je 1:2, onda Na 2 HPO 4 i ako je 1: 3, onda Na 3 PO 4. U srednjim slučajevima dolazi do mješavine soli.
Nađimo početne količine reagensa: ;  , – postoji srednja opcija između 1:1 i 1:2, tako da se reakcija odvija u dvije faze:
, – postoji srednja opcija između 1:1 i 1:2, tako da se reakcija odvija u dvije faze:
H 3 PO 4 + NaOH = NaH 2 PO 4 + H 2 O
NaH 2 PO 4 + NaOH = Na 2 HPO 4 + H 2 O
Dakle, u otopini nakon reakcije nalazi se mješavina soli - po 0,05 mola NaH 2 PO 4 i Na 2 HPO 4.
Uspjeh u realizaciji proračuni koristeći lance hemijskih jednačina u slučaju kada je proizvod jedne reakcije polazni materijal za drugu, zavisi od pravilnog izbora slijeda prijelaza iz jedne jednadžbe u drugu. Odabravši pomoćnu tvar u skladu s uvjetima problema, prikladno je koristiti strelice za označavanje redoslijeda izračunavanja, imajući na umu da se tvar dobivena u prethodnoj reakciji koristi u istoj količini u sljedećoj ako, naravno, nema gubitaka tokom čitavog višestepenog procesa i prinos svake reakcije je 100%.
Primjer 3. Koliko litara hlora i vodonika (n.s.) je potrebno da se dobije hlorovodonik sposoban da neutrališe alkalnu otopinu nastalu kada se 13,7 g barijuma otopi u vodi.
Sastavimo jednadžbe svih reakcija i koristimo strelice da označimo slijed izračunavanja:

Potporna supstanca barijum i njegova količina
(Ba) =  .
.
Lanac proračuna:
jednačina (I) - (Ba(OH) 2 / I) =  =>
=>
jednadžba (II) - (HCl / II)=> jednačina (III) –
(Cl 2) =(H 2) =  ,
,
tada je V(H 2) = V(Cl 2) = 0,1 mol · 22,4 l/mol = 2,24 l.
Prilikom odlučivanja problemi koji uključuju mješavine supstanci Potrebno je, pre svega, da svaka komponenta smeše posebno evidentira sve hemijske reakcije u kojima može da učestvuje u skladu sa uslovima problema. Supstance početne smeše obično se biraju kao potporne supstance i njihove količine (broj molova) označavaju kao nepoznanice - x, y, z, ...., a zatim se sastavljaju jednačine materijalnog bilansa prema broju, masi ili zapremine (za gasove) učesnika u hemijskim reakcijama, pri čemu se poslednje dve moraju izraziti u nepoznanicama. Broj jednadžbi ravnoteže mora biti jednak broju nepoznatih. U posljednjoj fazi rješava se rezultirajući sistem algebarskih jednačina.
Primjer 4. Sagorijevanjem 13,44 litara (br.) mješavine vodonika, metana i ugljičnog monoksida proizvedeno je 8,96 litara ugljičnog dioksida i 14,4 g vode. Odredite količinu gasova u smeši.
Jednačine reakcije:
2H 2 + O 2 = 2H 2 O (I)
CH 4 + 2O 2 = CO 2 + 2H 2 O (II)
2CO + O 2 = 2CO 2 (III)
Pomoćne supstance – CH 4, H 2 i CO; označimo njihove količine
ν(H 2) = x; ν(SH 4) = y; ν(CO) = z.
Kreirajmo tri jednadžbe ravnoteže na osnovu broja nepoznatih:
a) balans po zapremini smeše:
V (H 2) + V(CH 4) + V(CO) = 13,44 l, u njega unesite nepoznate:
xV m + yV m + zV m = 13,44 ili x + y + z =  0,6 mol;
0,6 mol;
b) saldo po količini CO 2:
ν(CO 2 / II) + ν(CO 2 / III) = ν ukupno. (CO 2), ali
 ;
;
ν(CO 2 / II) = ν(CH 4) = y; ν(CO 2 / III) =  z, tada je y + z = 0,4.
z, tada je y + z = 0,4.
c) stanje u količini H 2 O:
ν(H 2 O/ I) + ν(H 2 O/ II) = ν ukupno. (H 2 O), ali
 ,
,
 ;
; ,
,
tada je x + 2y = 0,8.
Dakle, dobijamo sistem jednačina oblika
 ,
,
koji se lako rješava usmeno
x = 0,2 mol; y = 0,3 mol; z = 0,1 mol.
Prilikom rješavanja računskih hemijskih problema potrebno je biti u stanju izvršiti proračune koristeći jednadžbu kemijske reakcije. Lekcija je posvećena proučavanju algoritma za izračunavanje mase (volumena, količine) jednog od učesnika reakcije iz poznate mase (volumena, količine) drugog učesnika reakcije.
Tema: Supstance i njihove transformacije
lekcija:Proračuni pomoću jednadžbe kemijske reakcije
Razmotrimo jednadžbu reakcije za stvaranje vode iz jednostavnih supstanci:
2H 2 + O 2 = 2H 2 O
Možemo reći da su dva molekula vode formirana od dva molekula vodonika i jednog molekula kiseonika. S druge strane, isti unos kaže da je za formiranje svaka dva mola vode potrebno uzeti dva mola vodonika i jedan mol kiseonika.
Molarni odnos učesnika u reakciji pomaže da se naprave proračuni važni za hemijsku sintezu. Pogledajmo primjere takvih proračuna.
ZADATAK 1. Odredimo masu vode koja nastaje kao rezultat sagorevanja vodika u 3,2 g kiseonika.
Da biste riješili ovaj problem, prvo morate napraviti jednadžbu za kemijsku reakciju i zapisati zadate uslove problema nad njom.
Kad bismo znali količinu kisika koja je reagirala, mogli bismo odrediti količinu vode. A onda bismo izračunali masu vode, znajući njenu količinu supstance i. Da biste pronašli količinu kiseonika, morate masu kiseonika podeliti sa njegovom molarnom masom.
Molarna masa je numerički jednaka relativnoj masi. Za kiseonik, ova vrijednost je 32. Zamijenimo je u formulu: količina kisikove supstance jednaka je omjeru od 3,2 g prema 32 g/mol. Ispostavilo se da je 0,1 mol.
Da bismo pronašli količinu vodene tvari, ostavimo proporciju koristeći molarni omjer sudionika reakcije:
Na svakih 0,1 mol kiseonika postoji nepoznata količina vode, a na svaki mol kiseonika 2 mola vode.
Stoga je količina vodene supstance 0,2 mol.
Da biste odredili masu vode, potrebno je pomnožiti pronađenu vrijednost količine vode njenom molarnom masom, tj. pomnožimo 0,2 mol sa 18 g/mol, dobijemo 3,6 g vode.
Rice. 1. Snimanje kratkog stanja i rješenja za problem 1
Osim mase, možete izračunati zapreminu učesnika gasovite reakcije (pri normalnim uslovima) koristeći vam poznatu formulu, prema kojoj je zapremina gasa u normalnim uslovima. jednak proizvodu količine gasovite supstance i molarne zapremine. Pogledajmo primjer rješavanja problema.
ZADATAK 2. Izračunajmo zapreminu kiseonika (u normalnim uslovima) koji se oslobađa pri razgradnji 27 g vode.
Zapišimo jednačinu reakcije i date uslove zadatka. Da biste pronašli volumen oslobođenog kisika, prvo morate pronaći količinu vodene tvari kroz masu, zatim pomoću jednadžbe reakcije odrediti količinu kisikove tvari, nakon čega možete izračunati njen volumen na nivou tla.
Količina vodene tvari jednaka je omjeru mase vode i njene molarne mase. Dobijamo vrijednost od 1,5 mol.
Napravimo proporciju: iz 1,5 mola vode nastaje nepoznata količina kiseonika, iz 2 mola vode formira se 1 mol kiseonika. Dakle, količina kiseonika je 0,75 mol. Izračunajmo zapreminu kiseonika u normalnim uslovima. On je jednak proizvodu količine kiseonika i molarne zapremine. Molarna zapremina bilo koje gasovite supstance u uslovima okoline. jednako 22,4 l/mol. Zamjenom numeričkih vrijednosti u formulu, dobivamo volumen kisika jednak 16,8 litara.
Rice. 2. Snimanje kratkog stanja i rješenja za problem 2
Poznavajući algoritam za rješavanje ovakvih problema, moguće je izračunati masu, zapreminu ili količinu supstance jednog od učesnika u reakciji iz mase, zapremine ili količine supstance drugog učesnika u reakciji.
1. Zbirka zadataka i vježbi iz hemije: 8. razred: za udžbenike. P.A. Oržekovski i dr. „Hemija. 8. razred” / P.A. Orzhekovsky, N.A. Titov, F.F. Hegel. - M.: AST: Astrel, 2006. (str.40-48)
2. Ushakova O.V. Radna sveska iz hemije: 8. razred: do udžbenika P.A. Oržekovski i dr. „Hemija. 8. razred” / O.V. Ushakova, P.I. Bespalov, P.A. Orzhekovsky; ispod. ed. prof. P.A. Oržekovski - M.: AST: Astrel: Profizdat, 2006. (str. 73-75)
3. Hemija. 8. razred. Udžbenik za opšte obrazovanje institucije / P.A. Orzhekovsky, L.M. Meshcheryakova, M.M. Shalashova. - M.: Astrel, 2013. (§23)
4. Hemija: 8. razred: udžbenik. za opšte obrazovanje institucije / P.A. Orzhekovsky, L.M. Meshcheryakova, L.S. Pontak. M.: AST: Astrel, 2005. (§29)
5. Hemija: neorganska. hemija: udžbenik. za 8. razred opšte obrazovanje osnivanje /G.E. Rudžitis, F.G. Feldman. - M.: Obrazovanje, OJSC “Moskovski udžbenici”, 2009. (str.45-47)
6. Enciklopedija za djecu. Tom 17. Hemija / Pogl. ed.V.A. Volodin, Ved. naučnim ed. I. Leenson. - M.: Avanta+, 2003.
Dodatni web resursi
2. Jedinstvena zbirka digitalnih obrazovnih resursa ().
Zadaća
1) str. 73-75, br. 2, 3, 5 iz Radne sveske iz hemije: 8. razred: do udžbenika P.A. Oržekovski i dr. „Hemija. 8. razred” / O.V. Ushakova, P.I. Bespalov, P.A. Orzhekovsky; ispod. ed. prof. P.A. Oržekovski - M.: AST: Astrel: Profizdat, 2006.
2) str.135 br.3,4 iz udžbenika P.A. Orzhekovsky, L.M. Meshcheryakova, M.M. Šalašova „Hemija: 8. razred“, 2013
Pažljivo proučite algoritme i zapišite ih u bilježnicu, sami riješite predložene probleme
I. Koristeći algoritam, sami riješite sljedeće probleme:
1. Izračunajte količinu supstance aluminijum oksida nastala kao rezultat interakcije aluminijuma sa količinom supstance od 0,27 mol sa dovoljnom količinom kiseonika (4 Al +3 O 2 =2 Al 2 O 3).
2. Izračunajte količinu tvari natrijevog oksida nastala kao rezultat interakcije natrijuma s količinom tvari od 2,3 mola s dovoljnom količinom kisika (4 Na+ O 2 =2 Na 2 O).
Algoritam br. 1
Izračunavanje količine supstance iz poznate količine supstance uključene u reakciju.
Primjer.Izračunajte količinu kisika koja se oslobađa kao rezultat razgradnje vode s količinom tvari od 6 mol.
|
Formatiranje zadatka |
|
|
1. Zapišite stanje problema |
Dato : ν(H 2 O) = 6 mol _____________ Nađi : ν(O 2)=? |
|
Rješenje : M(O 2)=32g/mol |
|
|
i postavite koeficijente |
2H 2 O=2H 2 +O 2 |
|
, a pod formulama - |
|
|
5. Za izračunavanje potrebne količine supstance, napravimo odnos |
|
|
6. Zapišite odgovor |
Odgovor: ν (O 2) = 3 mol |
II. Koristeći algoritam, sami riješite sljedeće probleme:
1. Izračunajte masu sumpora potrebnu da se dobije sumpor oksid ( S+ O 2 = SO 2).
2. Izračunajte masu litijuma potrebnu da se dobije litijum hlorid sa količinom supstance od 0,6 mol (2 Li+ Cl 2 =2 LiCl).
Algoritam br. 2
Izračunavanje mase tvari iz poznate količine druge tvari uključene u reakciju.
primjer:Izračunajte masu aluminija potrebnu da se dobije aluminij oksid s količinom tvari od 8 mol.
|
Redoslijed radnji |
Formatiranje rješenja problema |
|
1. Zapišite stanje problema |
Dato: ν( Al 2 O 3 )=8mol ___________ Pronađite: m( Al)=? |
|
2. Izračunajte molarne mase supstanci, o kojima se govori u problemu |
M( Al 2 O 3 )=102g/mol |
|
3. Napišimo jednačinu reakcije i postavite koeficijente |
4 Al + 3O 2 = 2Al 2 O 3 |
|
4. Iznad formula supstanci koje upisujemo količine supstanci iz iskaza problema , a pod formulama - stehiometrijski koeficijenti , prikazano jednadžbom reakcije |
|
|
5. Izračunajmo količinu supstance čija masa potrebno je pronaći. Da bismo to učinili, napravimo omjer. |
|
|
6. Izračunajte masu tvari koju treba pronaći |
m= ν ∙ M, m(Al)= ν (Al)∙ M(Al)=16mol∙27g/mol=432g |
|
7. Zapišite odgovor |
odgovor: m (Al)= 432 g |
III. Koristeći algoritam, sami riješite sljedeće probleme:
1. Izračunajte količinu natrijum sulfida ako je 12,8 g (2 Na+ S= Na 2 S).
2. Izračunajte količinu bakrene supstance koja nastaje ako bakrov oksid reaguje sa vodonikom ( II) težine 64 g ( CuO+ H2= Cu+ H 2 O).
Pažljivo proučite algoritam i zapišite ga u svoju bilježnicu.
Algoritam br. 3
Izračunavanje količine tvari iz poznate mase druge tvari uključene u reakciju.
Primjer.Izračunajte količinu bakrovog oksida ( I ), ako bakar mase 19,2 g reaguje sa kiseonikom.
|
Redoslijed radnji |
Formatiranje zadatka |
|
1. Zapišite stanje problema |
Dato: m( Cu)=19,2g ___________ Pronađite: ν( Cu 2 O)=? |
|
2. Izračunajte molarne mase supstanci, o kojima se govori u problemu |
M(Cu)=64g/mol |
|
3. Odrediti količinu tvari čija masa dato u opisu problema |
|
|
i postavite koeficijente |
4 Cu+ O 2 =2 Cu 2 O |
|
količine supstanci iz iskaza problema , a pod formulama - stehiometrijski koeficijenti , prikazano jednadžbom reakcije |
|
|
6. Za izračunavanje potrebne količine supstance, napravimo odnos |
|
|
7. Zapišite odgovor |
Odgovor: ν( Cu 2 O )=0,15 mol |
Pažljivo proučite algoritam i zapišite ga u svoju bilježnicu.
IV. Koristeći algoritam, sami riješite sljedeće probleme:
1. Izračunajte masu kiseonika potrebnu da reaguje sa gvožđem težine 112 g
(3 Fe+4 O 2 = Fe 3 O 4).
Algoritam br. 4
Izračunavanje mase supstance iz poznate mase druge supstance koja učestvuje u reakciji
Primjer.Izračunajte masu kiseonika koja je potrebna za sagorevanje fosfora, težine 0,31 g.
|
Redoslijed radnji |
Formatiranje zadatka |
|
1. Zapišite stanje problema |
Dato: m( P)=0,31g _________ Pronađite: m( O 2 )=? |
|
2. Izračunajte molarne mase supstanci, o kojima se govori u problemu |
M(P)=31g/mol M( O 2 )=32g/mol |
|
3. Odrediti količinu tvari čija je masa data u tekstu zadatka |
|
|
4. Napišimo jednačinu reakcije i postavite koeficijente |
4 P+5 O 2 = 2 P 2 O 5 |
|
5. Iznad formula supstanci koje upisujemo količine supstanci iz iskaza problema , a pod formulama - stehiometrijski koeficijenti , prikazano jednadžbom reakcije |
|
|
6. Izračunajte količinu tvari čiju masu treba pronaći m( O 2 )= ν ( O 2 )∙ M( O 2 )= 0,0125mol∙32g/mol=0,4g |
|
|
8. Zapišite odgovor |
odgovor: m ( O 2 )=0,4g
|
ZADACI ZA SAMOSTALNO RJEŠENJE
1. Izračunajte količinu supstance aluminijum oksida nastala kao rezultat interakcije aluminijuma sa količinom supstance od 0,27 mol sa dovoljnom količinom kiseonika (4 Al +3 O 2 =2 Al 2 O 3).
2. Izračunajte količinu tvari natrijevog oksida nastala kao rezultat interakcije natrijuma s količinom tvari od 2,3 mola s dovoljnom količinom kisika (4 Na+ O 2 =2 Na 2 O).
3. Izračunajte masu sumpora potrebnu da se dobije sumpor oksid ( IV) količina supstance 4 mol ( S+ O 2 = SO 2).
4. Izračunajte masu litijuma potrebnu da se dobije litijum hlorid sa količinom supstance od 0,6 mol (2 Li+ Cl 2 =2 LiCl).
5. Izračunajte količinu natrijum sulfida ako je sumpor mase 12,8 g (2 Na+ S= Na 2 S).
6. Izračunajte količinu bakra koja nastaje ako bakrov oksid reaguje sa vodonikom ( II) težine 64 g ( CuO+ H2=
Sažetak lekcije “Proračuni pomoću hemijskih jednačina”
1. Provjera domaćeg zadatka
Kao domaći zadatak, od vas se tražilo da postavite koeficijente u jednačine reakcije.Možete vidjeti obavljeni posao tokom pauze. Greške će sigurno biti.Je li sve uspjelo, ima li neko pitanja?Neka pričaju o svom kućnom iskustvu.
2. Najava teme i ažuriranje znanja
Tema današnje lekcije su proračuni pomoću hemijskih jednačina. Prvo, prisjetimo se svega što nam danas može biti od koristi. Već smo se susreli s kemijskim jednadžbama u prethodnom laboratorijskom radu, u domaćim zadacima, a još ranije u temi binarnih jedinjenja. Prisjetimo se definicije jednadžbe kemijske reakcije.
(ovo je konvencionalna notacija hemijske reakcije koja koristi hemijske formule i koeficijente.)
Nevjerovatno.
Kada proizvodite bilo koje spojeve, morate znati koliko polaznog materijala uzeti da biste dobili potrebnu masu produkta reakcije. Da biste to učinili, kreirajte jednadžbu za tekuću kemijsku reakciju i prilikom izračunavanja mase uzimaju u obzir molarne mase supstanci, a prilikom izračunavanja zapremine gasova uzeti u obzir vrijednostmolarni volumen gasovi
Ko pamti vrijednost molarne zapremine gasova u normalnim uslovima? (22,4 l/mol)
I koji su to normalni uslovi? (pritisak 101,3 kPa i temperatura 0 o C)
Odnosno, pod ovim uslovima, 1 mol BILO KOGA gasa zauzima zapreminu od 22,4 litara.
Zapravo, da bismo riješili probleme, moramo zapamtiti nekoliko veličina:
Molarna masa – M (g/mol)
Količina supstance – n (mol)
Volumen – V (l)
Bolje je ovako: zapamtite da je molarna masa numerički jednaka relativnoj atomskoj masi ili relativnoj molekulskoj masi supstance. Da biste to učinili, trebate koristiti periodičnu tablicu, gdje je relativna atomska masa naznačena na dnu svake „ćelije“. Ne zaboravljajući pravila zaokruživanja, koristimo cijelu vrijednost ove mase u proračunima.
Hemija je vrlo jasna, logična i konzistentna nauka, pa će za rješavanje problema biti zgodno koristiti ALGORITAM koji je dat u udžbeniku. Ovo je univerzalni slijed radnji koji se koristi za rješavanje bilo kojeg problema ove vrste.
Molimo vas da otvorite udžbenik i da se svi upoznamo sa algoritmom.
(ovdje svi zajedno otvaramo naše udžbenike, jedna osoba, možda ja, čita algoritam, ostali slijede da shvate šta sada moraju da urade)
Zvuči opširno, ali nadam se da nije previše zbunjujuće. Pokušajmo to shvatiti na primjeru.
Zadatak 1. Za proizvodnju vodonika, aluminijum se rastvara u sumpornoj kiselini: 2Al + 3H 2 SO 4 → Al 2 (SO 4 ) 3 + 3H 2 (Prva tačka našeg algoritma). Za reakciju smo uzeli 10,8 g aluminijuma. Izračunajte masu potrošene sumporne kiseline.
Dato: m(Al) = 10,8 g | Rješenje: m=10,8 g m - ? 2Al + 3H 2 SO 4 → Al 2 (SO 4 ) 3 + 3H 2 M=27g/mol M=98g/mol Ovdje možemo spomenuti da zapravo u reakciju ne ulaze 2 atoma aluminija i 3 molekula kiseline, već dio atoma aluminija i dio molekula kiseline. Ovaj dio u hemiji naziva se kratkom riječju "krtica". n=2 mol n=3 mol m = M ∙ n m=54 g m=294 g Obračun po proporcijama: |
||||
m (H 2 SO 4 ) - ? |
|||||
10,8 g | |||||
54 g | 294 g | ||||
10,8 g ∙ 294 g | |||||
54 g | |||||
X = 58,8 g Odgovor: m (H 2 SO 4 ) = 58,8 g |
|||||
To je sve rješenje problema. Imate pitanja? Hajdemo još jednom o rješenju:
Napravio jednačinu
Iznad supstanci smo potpisali ono što ZNAMO i šta ŽELIMO NAĆI
Pod formulama smo zapisali molarnu masu, količinu supstance istehiometrijski masa supstance ( bolje je navesti "masu prema periodnom sistemu")
Napravio proporciju
Rešena proporcija
Snimio odgovor
Rešimo sličan problem, ali sa gasovitim supstancama (ovde nećemo koristiti molarnu masu supstance, ali šta?...molarnu zapreminu)
Zadatak 2. 25 grama cink se rastvara u hlorovodoničkoj kiselini, tokom hemijske reakcije oslobađa se gas - vodonik. Izračunajte zapreminu oslobođenog vodonika.
Dato: m(Zn) = 10,8 g | Rješenje: m=25 g V - ? Zn + 2HCl → ZnCl 2 + H 2 M=65 g/mol V m=22,4 l/mol n=1 mol n=1 mol m=65 g V=22,4 l Obračun po proporcijama: |
||||
m(HCl) - ? |
|||||
25 g | |||||
65 g | 22,4 l | ||||
25 g ∙ 22,4 l | |||||
65 g | |||||
X = 8,61 l Odgovor: V(H 2 ) = 8,61 l |
|||||
Hajde da provjerimo kako ste savladali gradivo. Koristeći isti algoritam riješite problem:
NIJE ČINJENICA DA ĆETE BITI USPJEŠNI:
Kada reaguje sa korišćenjem ugljenih oksida Fe2O3 (prva opcija) i SnO2 (druga opcija) dobija se po 20 g Fe i Sn. Koliko grama svakog oksida je uzeto?
Imajte na umu da sada izračunavamo masu polaznih supstanci, a ne produkte reakcije)
(neka svi to riješe u svesci i selektivno zamolite da pokažu rješenje, mi ćemo svi zajedno napisati jednačinu na ploču, a svako će pokušati da je riješi sam)
Fe2O3 + 3C = 2Fe + 3CO m(Fe2O3)= 160*20/2*56= 28,5 g
SnO2+C=Sn+CO2 m(SnO2)= 20*151/119= 25,38 g
Domaći zadatak: proučiti materijal iz udžbenika str. 146-150, riješite problem
Kolika je masa kalcijum oksida, a kolika zapremina ugljičnog dioksida (n.s.)
može se dobiti razlaganjem kalcijum karbonata težine 250 g?TREBA DA SE DAJU ŠKOLAMAREADY EQUATIONDA DOVRŠITE OVAJ ZADATAK
Detaljan pregled lekcije „Proračuni pomoću hemijskih jednačina“.
udžbenik: O.S. Gabrielyan.
klasa: 8
Tema lekcije: Proračuni pomoću hemijskih jednadžbi.
Vrsta lekcije: kombinovano.
Obrazovni ciljevi: uvesti proračune koristeći hemijske jednačine; razvijati znanje učenika o proračunima pomoću hemijskih jednačina; početi razvijati vještine sastavljanja hemijskih jednačina i izračunavanja jednačina.
Edukativni zadaci: nastaviti formiranje prirodnonaučnog pogleda na svijet, ideje pojedinca i cjeline.
Razvojni zadaci: nastaviti razvijati sposobnost zapažanja, analiziranja, objašnjavanja i izvođenja zaključaka.
Nastavne metode: verbalno (objašnjenje i priča nastavnika), verbalno - vizuelno (objašnjenje uz pomoć beleški na tabli).
Oprema: tabla, tabela D.I. Mendeljejeva.
Tokom nastave:
1. Organizacioni trenutak (2-5 min.)
Zdravo momci, sedite. Danas u lekciji vi i ja ćemo morati da naučimo kako da izvršimo proračune koristeći hemijske jednačine.
2. Provjera znanja i vještina (10 – 15 min.)
U prethodnim časovima smo prošli kroz jednačine hemijskih reakcija, da se prisetimo šta je hemijska jednačina? (Hemijska jednačina je konvencionalni prikaz hemijske reakcije koristeći hemijske formule i matematičke simbole).
Na osnovu kog zakona se pišu hemijske reakcije? (Zakon održanja mase supstanci).
Kako to zvuči? (Masa supstanci koje su ušle u hemijsku reakciju jednaka je masi supstanci koje iz nje nastaju).
3. Objašnjenje novog materijala (20 – 30 min.)
Pomoću hemijske jednačine možete odrediti koje su supstance reagovale, a koje su nastale, a možete koristiti i hemijsku jednadžbu za izračunavanje mase, zapremine i količine reagujućih supstanci.
Za proračune je vrlo važno odabrati jedinice mase, zapremine i količine tvari koje odgovaraju jedna drugoj. Otvorimo udžbenike na strani 146 i pronađemo tabelu br. 7. Koristeći ovu tabelu, razmotrimo odnos nekih jedinica fizičkih i hemijskih veličina.
Da biste riješili računske probleme u hemiji, možete koristiti algoritam. Algoritam za rješavanje zadataka dat je u udžbeniku na strani 147.
Koristeći algoritam za rješavanje problema, riješimo sljedeći problem:
zadatak: Izračunajte volumen vodonika (br.) koji će biti potreban za reakciju sa 230 kg željeznog (III) oksida. Izračunajte količinu vode koja se formira u ovom slučaju.
Dato: Rješenje:
m(Fe 2 O 3) = 230 kg 1. Napišite jednačinu hemijske reakcije:
V(H 2) - ?
n(H 2 O) - ? 2. Zapišite poznate i nepoznate numeričke vrijednosti iznad formula supstanci u jednadžbi.
Pošto je masa data u kilogramima, nalazimo zapreminu u kubnim metrima, a količinu supstance u kilomolima. I onda:
230kg x m 3 y kmol
Fe 2 O 3 + 3H 2 = 2Fe + 3H 2 O
gdje je x zapremina vodonika V(H 2), y količina vodene supstance n(H 2 O).
3. a) Nađite masu 1 kmol Fe 2 O 3 određenu hemijskom jednadžbom i zapišite rezultujuću vrijednost pod njenom formulom:
Mr(Fe 2 O 3) = 56 * 2 + 16 * 3 = 160,
M(Fe 2 O 3) = 160 kg/kmol.
b) Nađite zapreminu od 3 kmol vodonika V = Vm*n zadanu jednačinom, upišite pronađenu vrijednost pod formulom vodonika: V(3H 2) = 22,4 m 3 /kmol * 3 kmol = 67,2 m 3.
c) Pod formulom vode navodimo njenu količinu specificiranu jednačinom - 3 kmol.
Jednačina postaje
230kg x m 3 y kmol
Fe 2 O 3 + 3H 2 = 2Fe + 3H 2 O
160 kg 67,2 m 3 3 kmol
4. Sastavimo i riješimo proporcije:
a) 230 = x, x = 230*67,2 = 201,6 (m3) – zapremina vodonika V(H2)
b) 230 = y, y = 230*3 = 9 (kmol) – količina vodene supstance n(H 2 O).
4.Primarna konsolidacija znanja (10 – 12 min.)
Riješite probleme (ako je moguće, na nekoliko načina):
Zadatak 1. 0,1 mol cinka reaguje sa kiseonikom. Koliko je kiseonika potrebno? Koliko cink oksida nastaje?
Zadatak 2. Cink reaguje sa kiseonikom u količini od 0,1 mol. Odredite masu kiseonika koji reaguje, kao i masu nastalog cink oksida.
Zadatak 3. Aluminij mase 6,3 g reagira s kisikom. Odredite mase kisika i rezultirajućeg željeznog oksida ako aluminij sadrži 20% nečistoća.
Zadatak 4. Koliki volumen vodonika (n.s.) će se osloboditi kada 2,7 g 25% hlorovodonične kiseline reaguje sa količinom aluminijuma koja je potrebna za reakciju? Kolika je ova količina supstance?
Zadatak 5. Kolika će se količina ugljičnog dioksida osloboditi kada se sagori 60 kg uglja?
Zadatak 6. Koliko molova kalcijum oksida nastaje kada se 8 g kalcija koji sadrži 30% nečistoća sagori u kisiku?
5. Sažetak lekcije (1 -3 min.)
Danas smo se na času još jednom prisjetili pisanja hemijskih jednadžbi i naučili kako izvršiti proračune pomoću hemijskih jednačina.
6. Domaći (1 – 4 min.)
§28, zadaci u radnim sveskama.
Kolika masa željeznog (III) oksida nastaje kada se 0,6 mol željeza sagori u zraku?
Izračunajte masu aluminijum sulfida koji nastaje kada se 5,4 g aluminijumskog praha stapa sa sumporom. Koliko grama željeznog (II) sulfida nastaje kada se 11,2 g željeznog praha spoji sa sumporom?
Odredite masu magnezijuma potrebnu za dobijanje 19 g magnezijum hlorida (na primer, sagorevanjem magnezijuma u hloru).
Koliko litara hlorovodonika nastaje kada hlor reaguje sa 5,5 litara vodonika?
Koja zapremina vodonika može reagovati sa 150 litara kiseonika?
Koliki volumen ugljičnog dioksida nastaje kada se sagori 8 litara metana CH4?
Koliki volumen ugljičnog dioksida nastaje kada se sagori 480 g uglja?
Koliki volumen kiseonika će se osloboditi kada se 100 g vode razgradi električnom strujom?
Kolika zapremina azota nastaje prilikom eksplozije 1 g azot-jodida:
2NJ 3 = N 2 + 3J 2
Koliko grama sumpor-oksida (IV) nastaje kada se sagori 12,8 sumpora?
Koja je masa magnezijevog oksida nastala kada je 6 g magnezijevih strugotina spaljeno u kisiku?
Koliko grama vode nastaje kada se 9 g vodonika sagori u kiseoniku?
Koliko grama aluminijuma treba uzeti da bi se dobilo 30,6 g aluminijum oksida?
Koliko grama litijuma treba sagorjeti u kisiku da bi se proizvelo 15 g litijum oksida?
Koliko grama natrijum hlorida nastaje kada se 11,5 g natrijuma sagori u hloru?
Koliko molova gvožđa treba uzeti da bi se dobilo 32,5 g gvožđe (III) hlorida?
Koliko grama aluminijuma je potrebno da se dobije 80,1 g aluminijum hlorida?
Koliko molova kalcijum oksida nastaje kada se 8 g kalcija sagori u kiseoniku?
Koliko grama aluminij hlorida nastaje kada se 10,8 g aluminijske folije sagori u hloru?

 krtica
krtica krtica
krtica


 krtica
krtica krtica
krtica