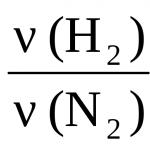Kemiberäkningar med kemiska ekvationer. Beräkning av massan av ett ämne med hjälp av ekvationen för en kemisk reaktion
Med hjälp av stökiometriska koefficienter omvandlas schemat för en kemisk reaktion till dess ekvation, som uttryckligen återspeglar lagen om bevarande av antalet atomer av varje typ under övergången från utgångsämnen (reagens) till reaktionsprodukter.
Stökiometriska koefficienter tillåter oss att fastställa ett samband mellan mängderna av ämnen som deltar i reaktionen baserat på följande regel:
koefficienter i en kemisk ekvation angermolar proportioner (förhållanden) i vilka utgångsämnen (reagens) reagerar och reaktionsprodukter bildas.
Betrakta, som ett exempel, ammoniaksyntesreaktionen:
3H2 + N2 = 2NH3,
som vi enligt ovanstående regel kan skriva för
där indexen är "ex". och "arr." motsvarar mängden reagerade och bildade ämnen. Det sista förhållandet kan presenteras i en annan form:
a) för ämnena H 2 och N 2: 
eller i annan form  ;
;
b) för ämnena H 2 och NH 3:  eller
eller  ;
;
c) för ämnen N 2 och NH 3:  eller
eller  .
.
Det är lätt att se att alla proportioner kan kombineras och skrivas i formen:
 =
= .
.
Den sista jämställdheten är grundläggande beräkningsekvation, kopplar samman mängderna av reagerade ämnen och de resulterande reaktionsprodukterna. Om nödvändigt kan massorna och volymerna av reaktionsdeltagare införas i denna ekvation från villkoren för problemet med hjälp av de vanliga sambanden.
Till exempel för reaktionen
4FeS 2 (t) + 11O 2 = 2Fe 2 O 3 (t) + 8SO 2 (g)
den huvudsakliga beräkningsekvationen är:
och om vi skriver in massorna som vanligtvis anges i problem för fasta ämnen och volymer för gaser, kommer det att ta följande form:
Beräkningsmetod att använda den grundläggande designekvationen för en kemisk reaktion inkluderar flera allmänna punkter:
1) Först och främst bestäms det stödjande ämnet, den kvantitet med vilken alla efterföljande beräkningar utförs. I problemformuleringen anges antingen massa eller volym eller koncentration för det, vilket i sin tur låter dig beräkna antalet mol av det stödjande ämnet. Detta är i regel inte särskilt svårt, men undantaget gäller de så kallade över- och bristproblemen, då stödsubstans behöver välja mellan två original. Faktum är att vid framställning av en reaktionsblandning kan utgångsämnena blandas i alla proportioner, men de kommer alltid att reagera med varandra i strikt definierade proportioner, vilket fastställer stökiometriska koefficienter för dem i den kemiska reaktionsekvationen. Under dessa förhållanden är en situation fullt möjlig när ett av utgångsämnena reagerar fullständigt, men en del av det andra förblir oreagerat, och då säger de att det första ämnet tas i brist i förhållande till det andra och omvänt det andra ämnet är i överskott i förhållande till den första. I detta fall bör utgångsämnet som tas i brist väljas som stödsubstans, eftersom det är dess kvantitet som avgör både reaktionens slutförande och mängden bildade produkter.
Hur bestämmer man ett stödsubstans om problemet innehåller data (massa, volym, etc.) för båda utgångsämnena? Låt två ämnen A och B reagera
aA + bB → reaktionsprodukter,
och de initiala mängderna av dessa ämnen 0 (A) och 0 (B) kan beräknas utifrån problemets förutsättningar.
För att svara på frågan måste du jämföra två siffror  , där tre alternativ är möjliga:
, där tre alternativ är möjliga:
jag var.  , då kallas den initiala reaktionsblandningen stökiometrisk och vilken som helst av dem - A eller B - kan väljas som stödsubstans;
, då kallas den initiala reaktionsblandningen stökiometrisk och vilken som helst av dem - A eller B - kan väljas som stödsubstans;
II var.  , då tas substans A i överskott och substans B kommer att vara den stödjande;
, då tas substans A i överskott och substans B kommer att vara den stödjande;
III var.  , då kommer substans B att vara i överskott och substans A kommer att vara den stödjande.
, då kommer substans B att vara i överskott och substans A kommer att vara den stödjande.
Slutet på irreversibla kemiska reaktioner i den första varianten inträffar vid det ögonblick då båda utgångsämnena försvinner samtidigt, och i de andra två - vid ögonblicket för försvinnandet av ämnet som tagits i brist, och i den slutliga blandningen av ämnen, tillsammans med reaktionsprodukterna kommer det att finnas en oreagerad rest av ämnet som tas i överskott.
2) Från huvudberäkningsekvationen följer en enkel regel för att bestämma antalet mol reagerade utgångsämnen och resulterande produkter enligt antalet mol av stödsubstansen:
För att bestämma antalet mol av ett ämne som reagerat eller bildas i en reaktion är det nödvändigt att dividera antalet mol av referensämnet med dess stökiometriska koefficient och multiplicera detta resultat med den stökiometriska koefficienten för det ämne som bestäms.
För reaktionen 2Al + 6HCl = 2AlCl 3 + H 2 ,
där det bärande ämnet till exempel är aluminium kan vi skriva:



Efter att ha bestämt kvantiteterna av ämnen av intresse för oss är det lätt att beräkna deras massor, volymer och koncentrationer, det vill säga de egenskaper hos deltagare i en kemisk reaktion som visas i problemformuleringen.
Således kan det allmänna beräkningsschemat för den kemiska reaktionsekvationen presenteras som:
Irreversibel reaktion.
Låta  Och
Och  initiala mängder av reagens A och B och
initiala mängder av reagens A och B och  , dvs. ämne A tas i överskott, då
, dvs. ämne A tas i överskott, då
a A+ V B = Med C+ d D
|
(överskott) |
(fel) | |||||
|
slut på reaktion: |
|
|
|
|||
Reversibel reaktion.
I detta fall slutar reaktionen med upprättandet av kemisk jämvikt och jämviktsblandningen innehåller både reaktionsprodukter och resten av utgångsämnena. Antag att när jämvikten är etablerad, t.ex. X mol av produkt C är alltså ett stödjande ämne
a A+ V B Med C+ d D
|
Början av reaktion: |
|
| ||
|
Jämvikt: |
|
|
|
|
Exempel 1. En lösning innehållande 20,0 g natriumhydroxid absorberade 6,72 liter koldioxid (n.o.). Bestäm reaktionsprodukterna och deras kvantiteter.
När en alkalilösning absorberar sura oxider (CO 2 , SO 2 , P 2 O 5 , etc.) eller väteföreningar (H 2 S , etc.), som motsvarar flerbasiska syror, i det första steget, med ett överskott av alkali , bildas alltid mediumsalter, som i det andra steget, i närvaro av ett överskott av absorberat reagens, de delvis eller helt omvandlas till sura salter:
CO 2 (gas) + 2 NaOH = Na 2 CO 3 + H 2 O
Den återstående koldioxiden reagerar med natriumkarbonat:
Na 2 CO 3 + CO 2 (gas) + H 2 O = 2 NaHCO 3
|
slut på reaktion: |
|
|
Så, lösningen innehåller en blandning av salter: 0,1 mol NaHCO 3 och 0,2 mol Na 2 CO 3.
Exempel 2. 6 g natriumhydroxid sattes till ett glas med 200 ml fosforsyralösning med en molär koncentration av 0,5 mol/l. Bestäm lösningens sammansättning efter reaktionens slut.
Vid neutralisering av flerbasiska syror med alkali (NaOH, KOH, NH 3, etc.), ersätts väteatomer successivt med en metall- eller ammoniumgrupp, och sammansättningen av reaktionsprodukterna beror på förhållandet mellan mängderna reagens. I vårt fall, om – NaH 2 PO 4 bildas; om 1:2, sedan Na 2 HPO 4 och om 1: 3, sedan Na 3 PO 4. I mellanliggande fall uppstår en blandning av salter.
Låt oss hitta de initiala mängderna reagens: ;  , – det finns ett mellanalternativ mellan 1: 1 och 1: 2, så reaktionen sker i två steg:
, – det finns ett mellanalternativ mellan 1: 1 och 1: 2, så reaktionen sker i två steg:
H3PO4 + NaOH = NaH2PO4 + H2O
NaH2PO4 + NaOH = Na2HPO4 + H2O
Så, i lösningen efter reaktionen finns en blandning av salter - 0,05 mol vardera av NaH 2 PO 4 och Na 2 HPO 4.
Framgång med att genomföra beräkningar med hjälp av kedjor av kemiska ekvationer i det fall där produkten av en reaktion är utgångsmaterialet för en annan, beror på det korrekta valet av sekvensen av övergångar från en ekvation till en annan. Efter att ha valt ett stödjande ämne enligt villkoren för problemet är det bekvämt att använda pilar för att indikera beräkningssekvensen, och kom ihåg att ämnet som erhölls i föregående reaktion används i samma mängd i den efterföljande om, naturligtvis, det finns inga förluster under hela flerstegsprocessen och utbytet av varje reaktion är 100 %.
Exempel 3. Hur många liter klor och väte (n.s.) behövs för att erhålla klorväte som kan neutralisera en alkalilösning som bildas när 13,7 g barium löses i vatten.
Låt oss komponera ekvationerna för alla reaktioner och använda pilar för att indikera sekvensen av beräkningar:

Stödsubstans barium och dess mängd
(Ba) =  .
.
Kedja av beräkningar:
ekvation (I) - (Ba(OH) 2 / I) =  =>
=>
ekvation (II) - (HCl / II)=> ekvation (III) –
(Cl 2) =(H 2) =  ,
,
sedan V(H2) = V(Cl2) = 0,1 mol · 22,4 l/mol = 2,24 l.
När man bestämmer sig problem med blandningar av ämnen Det är först och främst nödvändigt för varje komponent i blandningen att separat registrera alla kemiska reaktioner i vilka den kan delta i enlighet med villkoren för problemet. Ämnen i den initiala blandningen väljs vanligtvis ut som bärande ämnen och deras kvantiteter (antal mol) betecknas som okända - x, y, z, ...., och sedan ritas materialbalansekvationer enligt antal, massa resp. volym (för gaser) av deltagare i kemiska reaktioner, där de två sista måste uttryckas i termer av okända. Antalet balansekvationer måste vara lika med antalet okända. I det sista steget löses det resulterande systemet av algebraiska ekvationer.
Exempel 4. Förbränningen av 13,44 liter (antal) av en blandning av väte, metan och kolmonoxid gav 8,96 liter koldioxid och 14,4 g vatten. Bestäm mängden gaser i blandningen.
Reaktionsekvationer:
2H2 + O2 = 2H2O (I)
CH 4 + 2O 2 = CO 2 + 2H 2 O (II)
2CO + O 2 = 2CO 2 (III)
Stödämnen – CH 4, H 2 och CO; låt oss beteckna deras kvantiteter
v(H2) = x; v(СH4) = y; v(CO) = z.
Låt oss skapa tre balansekvationer baserat på antalet okända:
a) volymbalans av blandningen:
V (H 2) + V(CH 4) + V(CO) = 13,44 l, skriv in det okända i det:
xV m + yV m + zV m = 13,44 eller x + y + z =  0,6 mol;
0,6 mol;
b) balansera med mängden CO 2:
ν(CO 2 / II) + ν(CO 2 / III) = ν totalt. (CO 2), men
 ;
;
v(CO2/II) = v(CH4) = y; ν(CO 2 / III) =  z, då y + z = 0,4.
z, då y + z = 0,4.
c) balans i mängden H 2 O:
ν(H2O/I) + ν(H2O/II) = ν totalt. (H2O), men
 ,
,
 ;
; ,
,
då x + 2y = 0,8.
Så vi får ett ekvationssystem av formen
 ,
,
som lätt löses muntligt
x = 0,2 mol; y = 0,3 mol; z = 0,1 mol.
Vid lösning av beräkningskemiska problem är det nödvändigt att kunna utföra beräkningar med hjälp av ekvationen för en kemisk reaktion. Lektionen ägnas åt att studera algoritmen för att beräkna massan (volym, kvantitet) för en av reaktionsdeltagarna från den kända massan (volym, kvantitet) för en annan reaktionsdeltagare.
Ämne: Ämnen och deras omvandlingar
Lektion:Beräkningar med hjälp av den kemiska reaktionsekvationen
Betrakta reaktionsekvationen för bildandet av vatten från enkla ämnen:
2H2 + O2 = 2H2O
Vi kan säga att två molekyler vatten bildas av två molekyler väte och en molekyl syre. Å andra sidan säger samma post att för att bilda varannan mol vatten måste du ta två mol väte och en mol syre.
Molförhållandet mellan reaktionsdeltagare hjälper till att göra beräkningar viktiga för kemisk syntes. Låt oss titta på exempel på sådana beräkningar.
UPPGIFT 1. Låt oss bestämma massan av vatten som bildas som ett resultat av förbränning av väte i 3,2 g syre.
För att lösa detta problem måste du först skapa en ekvation för en kemisk reaktion och skriva ner de givna förhållandena för problemet över den.
Om vi visste hur mycket syre som reagerade skulle vi kunna bestämma mängden vatten. Och sedan skulle vi beräkna massan av vatten, med kunskap om dess mängd substans och. För att hitta mängden syre måste du dela syremassan med dess molära massa.
Molmassan är numeriskt lika med relativ massa. För syre är detta värde 32. Låt oss ersätta det i formeln: mängden syresubstans är lika med förhållandet 3,2 g till 32 g/mol. Det visade sig vara 0,1 mol.
För att hitta mängden vattensubstans, låt oss lämna andelen med hjälp av molförhållandet för reaktionsdeltagarna:
För varje 0,1 mol syre finns det en okänd mängd vatten, och för varje mol syre finns det 2 mol vatten.
Därför är mängden vattensubstans 0,2 mol.
För att bestämma massan av vatten måste du multiplicera det funna värdet av mängden vatten med dess molära massa, d.v.s. multiplicera 0,2 mol med 18 g/mol får vi 3,6 g vatten.
Ris. 1. Spela in ett kort tillstånd och lösning på problem 1
Förutom massan kan du beräkna volymen av den gasformiga reaktionsdeltagaren (vid normala förhållanden) med hjälp av en formel som du känner till, enligt vilken volymen av gas vid normala förhållanden. lika med produkten av mängden gasämne och molvolymen. Låt oss titta på ett exempel på att lösa ett problem.
UPPGIFT 2. Låt oss beräkna volymen syre (vid normala förhållanden) som frigörs under nedbrytningen av 27 g vatten.
Låt oss skriva ner reaktionsekvationen och de givna förhållandena för problemet. För att hitta volymen syre som frigörs måste du först hitta mängden vattenämne genom massan, sedan, med hjälp av reaktionsekvationen, bestämma mängden syreämne, varefter du kan beräkna dess volym vid marknivå.
Mängden vattensubstans är lika med förhållandet mellan vattenmassan och dess molära massa. Vi får ett värde på 1,5 mol.
Låt oss göra en proportion: från 1,5 mol vatten bildas en okänd mängd syre, från 2 mol vatten bildas 1 mol syre. Därför är mängden syre 0,75 mol. Låt oss beräkna volymen syre vid normala förhållanden. Det är lika med produkten av mängden syre och molvolymen. Den molära volymen av något gasformigt ämne vid omgivningsförhållanden. lika med 22,4 l/mol. Genom att ersätta de numeriska värdena i formeln får vi en volym syre lika med 16,8 liter.
Ris. 2. Spela in ett kort tillstånd och lösning på problem 2
Genom att känna till algoritmen för att lösa sådana problem är det möjligt att beräkna massan, volymen eller mängden ämne hos en av reaktionsdeltagarna från massan, volymen eller mängden ämne hos en annan reaktionsdeltagare.
1. Samling av problem och övningar i kemi: årskurs 8: för läroböcker. P.A. Orzhekovsky och andra. "Kemi. 8:e klass” / P.A. Orzhekovsky, N.A. Titov, F.F. Hegel. - M.: AST: Astrel, 2006. (s.40-48)
2. Ushakova O.V. Arbetsbok i kemi: årskurs 8: till läroboken av P.A. Orzhekovsky och andra. "Kemi. 8:e klass” / O.V. Ushakova, P.I. Bespalov, P.A. Orzhekovsky; under. ed. prof. P.A. Orzhekovsky - M.: AST: Astrel: Profizdat, 2006. (s. 73-75)
3. Kemi. 8: e klass. Lärobok för allmänbildning institutioner / P.A. Orzhekovsky, L.M. Meshcheryakova, M.M. Shalashova. - M.: Astrel, 2013. (§23)
4. Kemi: årskurs 8: lärobok. för allmänbildning institutioner / P.A. Orzhekovsky, L.M. Meshcheryakova, L.S. Pontak. M.: AST: Astrel, 2005. (§29)
5. Kemi: oorganiskt. kemi: lärobok. för 8:e klass Allmän utbildning etablering /G.E. Rudzitis, F.G. Feldman. - M.: Education, OJSC “Moscow Textbooks”, 2009. (s.45-47)
6. Encyklopedi för barn. Volym 17. Kemi / Kapitel. ed.V.A. Volodin, Ved. vetenskaplig ed. I. Leenson. - M.: Avanta+, 2003.
Ytterligare webbresurser
2. Enhetlig samling av digitala utbildningsresurser ().
Läxa
1) sid. 73-75 nr 2, 3, 5 från Arbetsboken i kemi: årskurs 8: till läroboken av P.A. Orzhekovsky och andra. "Kemi. 8:e klass” / O.V. Ushakova, P.I. Bespalov, P.A. Orzhekovsky; under. ed. prof. P.A. Orzhekovsky - M.: AST: Astrel: Profizdat, 2006.
2) s. 135 nr 3,4 från läroboken P.A. Orzhekovsky, L.M. Meshcheryakova, M.M. Shalashova "Kemi: 8:e klass," 2013
Studera noggrant algoritmerna och skriv ner dem i en anteckningsbok, lös de föreslagna problemen själv
I. Använd algoritmen och lös följande problem själv:
1. Beräkna mängden aluminiumoxidämne som bildas som ett resultat av växelverkan mellan aluminium och en mängd ämne på 0,27 mol med en tillräcklig mängd syre (4) Al +3 O2=2 Al 2 O 3).
2. Beräkna mängden natriumoxidämne som bildas som ett resultat av växelverkan mellan natrium och en 2,3 mol mängd ämne med en tillräcklig mängd syre (4 Na+ O2=2 Na 2 O).
Algoritm nr 1
Beräkna mängden av ett ämne från en känd mängd av ämnet som är involverat i en reaktion.
Exempel.Beräkna mängden syre som frigörs till följd av nedbrytningen av vatten med en ämnesmängd på 6 mol.
|
Formatera en uppgift |
|
|
1. Skriv ner tillståndet för problemet |
Given : v(H2O) = 6 mol _____________ Hitta : v(O2)=? |
|
Lösning : M(02)=32 g/mol |
|
|
och ställ in koefficienterna |
2H2O=2H2+O2 |
|
, och under formlerna - |
|
|
5. För att beräkna den nödvändiga mängden av ett ämne, låt oss göra ett förhållande |
|
|
6. Skriv ner svaret |
Svar: ν (O 2) = 3 mol |
II. Använd algoritmen för att lösa följande problem själv:
1. Beräkna massan svavel som krävs för att erhålla svaveloxid ( S+ O2 = SO 2).
2. Beräkna massan litium som krävs för att erhålla litiumklorid med en ämnesmängd på 0,6 mol (2) Li+ Cl2=2 LiCl).
Algoritm nr 2
Beräkna massan av ett ämne från en känd mängd av ett annat ämne som är involverat i en reaktion.
Exempel:Beräkna vikten av aluminium som krävs för att erhålla aluminiumoxid med en ämnesmängd på 8 mol.
|
Handlingssekvens |
Formatera en lösning på ett problem |
|
1. Skriv ner tillståndet för problemet |
Given: ν( Al 2 O 3 )=8 mol ___________ Hitta: m( Al)=? |
|
2. Beräkna molmassorna av ämnen, som diskuteras i problemet |
M( Al 2 O 3 )=102 g/mol |
|
3. Låt oss skriva reaktionsekvationen och ställ in koefficienterna |
4 Al + 3O2 = 2Al2O3 |
|
4. Ovanför formlerna för ämnen skriver vi mängder ämnen från problembeskrivningen , och under formlerna - stökiometriska koefficienter , visas av reaktionsekvationen |
|
|
5. Låt oss beräkna mängden ämne vars massa krävs för att hittas. För att göra detta, låt oss skapa ett förhållande. |
|
|
6. Beräkna massan av ämnet som behöver hittas |
m= ν ∙ M, m(Al)= ν (Al)∙ M(Al)=16mol∙27g/mol=432g |
|
7. Skriv ner svaret |
Svar: m (Al)= 432 g |
III. Använd algoritmen för att lösa följande problem själv:
1. Beräkna mängden natriumsulfidsubstans om 12,8 g (2 Na+ S= Na 2 S).
2. Beräkna mängden kopparämne som bildas om kopparoxid reagerar med väte ( II) väger 64 g ( CuO+ H2= Cu+ H 2 O).
Studera algoritmen noggrant och skriv ner den i din anteckningsbok.
Algoritm nr 3
Beräkna mängden av ett ämne från den kända massan av ett annat ämne som är involverat i en reaktion.
Exempel.Beräkna mängden kopparoxidämne ( jag ), om koppar som väger 19,2 g reagerar med syre.
|
Handlingssekvens |
Formatera en uppgift |
|
1. Skriv ner tillståndet för problemet |
Given: m( Cu)=19,2g ___________ Hitta: ν( Cu 2 O)=? |
|
2. Beräkna molmassorna av ämnen, som diskuteras i problemet |
M(Cu)=64g/mol |
|
3. Hitta mängden ämne vars massa ges i problemformuleringen |
|
|
och ställ in koefficienterna |
4 Cu+ O 2 =2 Cu 2 O |
|
mängder ämnen från problembeskrivningen , och under formlerna - stökiometriska koefficienter , visas av reaktionsekvationen |
|
|
6. För att beräkna den nödvändiga mängden av ett ämne, låt oss göra ett förhållande |
|
|
7. Skriv ner svaret |
Svar: ν( Cu 2 O )=0,15 mol |
Studera algoritmen noggrant och skriv ner den i din anteckningsbok.
IV. Använd algoritmen för att lösa följande problem själv:
1. Beräkna mängden syre som krävs för att reagera med järn som väger 112 g
(3 Fe+4 O2 = Fe 3 O 4).
Algoritm nr 4
Beräkna massan av ett ämne från den kända massan av ett annat ämne som deltar i reaktionen
Exempel.Beräkna mängden syre som krävs för förbränning av fosfor, som väger 0,31 g.
|
Handlingssekvens |
Formatera uppgiften |
|
1. Skriv ner tillståndet för problemet |
Given: m( P)=0,31 g _________ Hitta: m( O 2 )=? |
|
2. Beräkna molmassorna av ämnen, som diskuteras i problemet |
M(P)=31 g/mol M( O 2 )=32g/mol |
|
3. Hitta mängden ämne vars massa anges i problemformuleringen |
|
|
4. Låt oss skriva reaktionsekvationen och ställ in koefficienterna |
4 P+5 O 2 = 2 P 2 O 5 |
|
5. Ovanför formlerna för ämnen skriver vi mängder ämnen från problembeskrivningen , och under formlerna - stökiometriska koefficienter , visas av reaktionsekvationen |
|
|
6. Beräkna mängden ämne vars massa behöver hittas m( O 2 )= ν ( O 2 )∙ M( O 2 )= 0,0125mol∙32g/mol=0,4g |
|
|
8. Skriv ner svaret |
Svar: m ( O 2 )=0,4 g
|
UPPGIFTER FÖR OBEROENDE LÖSNING
1. Beräkna mängden aluminiumoxidämne som bildas som ett resultat av växelverkan mellan aluminium och en mängd ämne på 0,27 mol med en tillräcklig mängd syre (4) Al +3 O2=2 Al 2 O 3).
2. Beräkna mängden natriumoxidämne som bildas som ett resultat av växelverkan mellan natrium och en 2,3 mol mängd ämne med en tillräcklig mängd syre (4 Na+ O2=2 Na 2 O).
3. Beräkna massan svavel som krävs för att erhålla svaveloxid ( IV) mängd ämne 4 mol ( S+ O2 = SO 2).
4. Beräkna massan litium som krävs för att erhålla litiumklorid med en ämnesmängd på 0,6 mol (2) Li+ Cl2=2 LiCl).
5. Beräkna mängden natriumsulfid om svavel väger 12,8 g (2 Na+ S= Na 2 S).
6. Beräkna mängden koppar som bildas om kopparoxid reagerar med väte ( II) väger 64 g ( CuO+ H2=
Lektionssammanfattning "Beräkningar med kemiska ekvationer"
1. Kontrollera läxor
Som läxa blev du ombedd att placera koefficienter i reaktionsekvationer.Du kan se arbetet som utförs under pausen. Det kommer säkert att bli misstag.Har allt löst sig, är det någon som har några frågor?Låt dem berätta om sin hemupplevelse.
2. Tillkännagivande av ämne och uppdatering av kunskap
Ämnet för dagens lektion är beräkningar med kemiska ekvationer. Låt oss först komma ihåg allt som kan vara användbart för oss idag. Vi har redan stött på kemiska ekvationer i tidigare laborationer, i läxor och ännu tidigare i ämnet binära föreningar. Låt oss komma ihåg definitionen av ekvationen för en kemisk reaktion.
(detta är en konventionell notation av en kemisk reaktion med kemiska formler och koefficienter.)
Fantastisk.
När du tillverkar några föreningar måste du veta hur mycket utgångsmaterial som ska tas för att erhålla den erforderliga massan av reaktionsprodukten. För att göra detta, skapa en ekvation för den pågående kemiska reaktionen och vid beräkning massor tar hänsyn till molära massor ämnen, och vid beräkning volymer av gaser ta hänsyn till värdetmolar volym gaser
Vem kommer ihåg värdet på den molära volymen av gaser under normala förhållanden? (22,4 l/mol)
Och vilka är dessa normala förhållanden? (tryck 101,3 kPa och temperatur 0 o C)
Det vill säga, under dessa förhållanden upptar 1 mol ALLA gas en volym på 22,4 liter.
För att lösa problem måste vi faktiskt komma ihåg flera kvantiteter:
Molmassa – M (g/mol)
Mängd ämne – n (mol)
Volym – V (l)
Det är bättre så här: du kommer ihåg att molmassan numeriskt är lika med den relativa atommassan eller relativa molekylmassan för ett ämne. För att göra detta måste du använda det periodiska systemet, där den relativa atommassan anges längst ner på varje "cell". För att inte glömma avrundningsreglerna använder vi hela värdet av denna massa i beräkningar.
Kemi är en mycket tydlig, logisk och konsekvent vetenskap, därför kommer det att vara bekvämt att använda ALGORITMEN, som ges i läroboken, för att lösa problem. Detta är en universell sekvens av åtgärder som används för att lösa alla problem av denna typ.
Öppna läroboken och låt oss alla bekanta oss med algoritmen.
(här öppnar vi alla våra läroböcker tillsammans, en person, kanske jag, läser algoritmen, resten följer för att förstå vad de måste göra nu)
Det låter omfattande, men jag hoppas att det inte är för förvirrande. Låt oss försöka lista ut det med ett exempel.
Uppgift 1. För att producera väte löses aluminium i svavelsyra: 2Al + 3H 2SO4 → Al2(SO4)3 + 3H2 (Den första punkten i vår algoritm). För reaktionen tog vi 10,8 g aluminium. Beräkna massan svavelsyra som förbrukas.
Given: m(Al) = 10,8 g | Lösning: m=10,8 g m - ? 2Al + 3H2SO4 → Al2(SO4)3 + 3H2 M=27g/mol M=98g/mol Här kan vi nämna att faktiskt inte 2 aluminiumatomer och 3 syramolekyler går in i reaktionen, utan en del av aluminiumatomer och en del av syramolekyler. Denna del i kemi kallas det korta ordet "mullvad". n=2 mol n=3 mol m = M ∙ n m=54 g m=294 g Beräkning efter proportion: |
||||
m (H2SO4) -? |
|||||
10,8 g | |||||
54 g | 294 g | ||||
10,8 g ∙ 294 g | |||||
54 g | |||||
X = 58,8 g Svar: m (H 2 SO 4 ) = 58,8 g |
|||||
Det är hela lösningen på problemet. Har frågor? Låt oss prata om lösningen en gång till:
Gjorde en ekvation
Ovanför ämnena skrev vi under på vad vi VET och vad vi VILL FINNA
Under formlerna skrev vi ner molmassan, mängden ämne ochstökiometrisk massan av ämnet ( det är bättre att ange "massa enligt det periodiska systemet")
Utgjorde en proportion
Löste proportionen
Spelade in svaret
Låt oss lösa ett liknande problem, men med gasformiga ämnen (här kommer vi inte att använda ämnets molära massa, men vad?...molar volym)
Uppgift 2. 25 gram zink löses i saltsyra, under den kemiska reaktionen frigörs en gas - väte. Beräkna volymen väte som frigörs.
Given: m(Zn) = 10,8 g | Lösning: m=25 g V-? Zn + 2HCl → ZnCl2 + H2 M=65 g/mol V m=22,4 l/mol n=1 mol n=1 mol m=65 g V=22,4 l Beräkning efter proportion: |
||||
m(HCl)-? |
|||||
25 g | |||||
65 g | 22,4 l | ||||
25 g ∙ 22,4 l | |||||
65 g | |||||
X = 8,61 1 Svar: V(H 2 ) = 8,61 l |
|||||
Låt oss kolla hur du har bemästrat materialet. Använd samma algoritm för att lösa problemet:
DET ÄR INTE ETT FAKTUM ATT DU KOMMER ATT LYCKAS:
När man reagerar med med användning av koloxider Fe2O3 (första alternativet) och SnO2 (andra alternativet) fick vardera 20 g Fe och Sn. Hur många gram av varje oxid togs?
Observera att vi nu beräknar massan av utgångsämnena, inte reaktionsprodukterna)
(låt alla lösa det i en anteckningsbok och be dem selektivt visa lösningen, vi kommer att skriva ekvationen tillsammans på tavlan, och alla kommer att försöka lösa det själva)
Fe2O3 + 3C = 2Fe + 3CO m(Fe2O3)= 160*20/2*56= 28,5 g
SnO2+C=Sn+CO2 m(SnO2)= 20*151/119= 25,38 g
Läxor: studera läroboksmaterialet sid. 146-150, lös problemet
Vad är massan av kalciumoxid och vad är volymen koldioxid (n.s.)
kan erhållas genom att sönderdela kalciumkarbonat som väger 250 g?BÖR GE TILL SKOLBARNFÄRDIG EKVATIONFÖR ATT SLUTFÖRA DENNA UPPGIFT
Detaljerad översikt av lektionen "Beräkningar med kemiska ekvationer."
Lärobok: O.S. Gabrielyan.
Klass: 8
Lektionens ämne: Beräkningar med kemiska ekvationer.
Lektionstyp: kombinerad.
Utbildningsmål: införa beräkningar med kemiska ekvationer; att utveckla elevernas kunskaper om beräkningar med kemiska ekvationer; börja utveckla färdigheter i att sammanställa kemiska ekvationer och beräkna ekvationer.
Pedagogiska uppgifter: fortsätta bildandet av en naturvetenskaplig världsbild, en idé om individen och helheten.
Utvecklingsuppgifter: fortsätta att utveckla förmågan att observera, analysera, förklara och dra slutsatser.
Lär ut metoder: verbal (förklaring och berättelse om läraren), verbal - visuell (förklaring med anteckningar på tavlan).
Utrustning: svarta tavlan, bord av D.I. Mendeleev.
Under lektionerna:
1. Organisatoriskt ögonblick (2–5 min.)
Hej killar, sätt er. Idag i lektionen måste du och jag lära dig hur man utför beräkningar med kemiska ekvationer.
2. Test av kunskaper och färdigheter (10 – 15 min.)
I tidigare klasser gick vi igenom ekvationer av kemiska reaktioner, låt oss komma ihåg vad en kemisk ekvation är? (En kemisk ekvation är en konventionell representation av en kemisk reaktion med kemiska formler och matematiska symboler).
På grundval av vilken lag skrivs kemiska reaktioner? (lagen om bevarande av massa av ämnen).
Hur låter det? (Massan av ämnen som ingick i en kemisk reaktion är lika med massan av ämnen som härrör från den).
3. Förklaring av nytt material (20 – 30 min.)
Med hjälp av en kemisk ekvation kan man avgöra vilka ämnen som reagerat och vilka som bildades, och man kan även använda en kemisk ekvation för att beräkna massa, volym och mängd av reagerande ämnen.
För beräkningar är det mycket viktigt att välja enheter för massa, volym och kvantitet av ett ämne som motsvarar varandra. Låt oss öppna läroböckerna på sidan 146 och hitta tabell nr 7. Med hjälp av denna tabell, låt oss överväga förhållandet mellan vissa enheter av fysiska och kemiska kvantiteter.
För att lösa beräkningsproblem i kemi kan du använda en algoritm. Algoritmen för att lösa problem finns i läroboken på sidan 147.
Med hjälp av problemlösningsalgoritmen, låt oss lösa följande problem:
Uppgift: Beräkna volymen väte (antal) som kommer att krävas för att reagera med 230 kg järn(III)oxid. Beräkna mängden vatten som bildas i detta fall.
Givet: Lösning:
m(Fe 2 O 3) = 230 kg 1. Skriv ekvationen för den kemiska reaktionen:
V(H2)-?
n(H2O)-? 2. Skriv ner de kända och okända numeriska värdena ovanför formlerna för ämnena i ekvationen.
Eftersom massan anges i kilogram, hittar vi volymen i kubikmeter, och mängden ämne i kilomol. Och då:
230 kg x m 3 år kmol
Fe2O3 + 3H2 = 2Fe + 3H2O
där x är volymen väte V(H 2), y är mängden vattensubstans n(H 2 O).
3. a) Hitta massan av 1 kmol Fe 2 O 3 specificerad av den kemiska ekvationen och skriv det resulterande värdet under dess formel:
Mr(Fe2O3) = 56 * 2 + 16 * 3 = 160,
M(Fe2O3) = 160 kg/kmol.
b) Hitta volymen av 3 kmol väte V = Vm*n specificerad av ekvationen, skriv det funna värdet under väteformeln: V(3H 2) = 22,4 m 3 /kmol * 3 kmol = 67,2 m 3.
c) Under formeln för vatten anger vi dess mängd specificerad av ekvationen - 3 kmol.
Ekvationen blir
230 kg x m 3 år kmol
Fe2O3 + 3H2 = 2Fe + 3H2O
160kg 67,2 m 3 3 kmol
4. Låt oss komponera och lösa proportionerna:
a) 230 = x, x = 230*67,2 = 201,6 (m3) – volym väte V(H2)
b) 230 = y, y = 230*3 = 9 (kmol) – mängden vattenämne n(H 2 O).
4. Primär konsolidering av kunskap (10 – 12 min.)
Lös problemen (om möjligt på flera sätt):
Uppgift 1. 0,1 mol zink reagerar med syre. Hur mycket syre krävs? Hur mycket zinkoxid bildas?
Uppgift 2. Zink reagerar med syre i en mängd av 0,1 mol. Bestäm massan av syre som reagerar, liksom massan av bildad zinkoxid.
Uppgift 3. Aluminium som väger 6,3 g reagerar med syre. Bestäm syremassorna och den resulterande järnoxiden om aluminium innehåller 20 % föroreningar.
Uppgift 4. Vilken volym väte (n.s.) kommer att frigöras när 2,7 g 25 % saltsyra reagerar med den mängd aluminium som reaktionen kräver? Vad är denna mängd substans?
Uppgift 5. Hur mycket koldioxid kommer att frigöras när 60 kg kol förbränns?
Uppgift 6. Hur många mol kalciumoxid bildas när 8 g kalcium som innehåller 30 % föroreningar förbränns i syre?
5. Lektionssammanfattning (1 -3 min.)
Idag på lektionen kom vi återigen ihåg att skriva kemiska ekvationer och lärde oss hur man utför beräkningar med kemiska ekvationer.
6. Läxor (1 – 4 min.)
§28, uppgift i arbetsböcker.
Vilken massa järn(III)oxid bildas när 0,6 mol järn förbränns i luft?
Beräkna massan av aluminiumsulfid som bildas när 5,4 g aluminiumpulver smälts samman med svavel. Hur många gram järn(II)sulfid bildas när 11,2 g järnpulver smälts samman med svavel?
Bestäm mängden magnesium som krävs för att få 19 g magnesiumklorid (till exempel genom att bränna magnesium i klor).
Hur många liter väteklorid bildas när klor reagerar med 5,5 liter väte?
Vilken volym väte kan reagera med 150 liter syre?
Vilken volym koldioxid bildas när 8 liter metan CH 4 förbränns?
Vilken volym koldioxid produceras när 480 g kol förbränns?
Vilken volym syre kommer att frigöras när 100 g vatten bryts ner av elektrisk ström?
Vilken volym kväve bildas vid explosionen av 1 g kvävejodid:
2NJ3 = N2 + 3J2
Hur många gram svaveloxid (IV) bildas när 12,8 svavel förbränns?
Vilken massa magnesiumoxid bildades när 6 g magnesiumspån brändes i syre?
Hur många gram vatten produceras när 9 g väte förbränns i syre?
Hur många gram aluminium måste tas för att få 30,6 g aluminiumoxid?
Hur många gram litium måste förbrännas i syre för att producera 15 g litiumoxid?
Hur många gram natriumklorid bildas när 11,5 g natrium förbränns i klor?
Hur många mol järn måste tas för att få 32,5 g järn(III)klorid?
Hur många gram aluminium behövs för att få 80,1 g aluminiumklorid?
Hur många mol kalciumoxid bildas när 8 g kalcium förbränns i syre?
Hur många gram aluminiumklorid produceras när 10,8 g aluminiumfolie bränns i klor?

 mol
mol mol
mol


 mol
mol mol
mol