Aggiunta di cloro. Essere nella natura
Il cloro fu probabilmente ottenuto dagli alchimisti, ma la sua scoperta e le prime ricerche sono indissolubilmente legate al nome del famoso chimico svedese Carl Wilhelm Scheele. Scheele scoprì cinque elementi chimici: bario e manganese (insieme a Johan Hahn), molibdeno, tungsteno, cloro e, indipendentemente da altri chimici (anche se più tardi), altri tre: ossigeno, idrogeno e azoto. Questo risultato non potrebbe essere ripetuto successivamente da nessun chimico. Allo stesso tempo, Scheele, già eletto membro dell'Accademia reale svedese delle scienze, era un semplice farmacista a Köping, anche se avrebbe potuto assumere una posizione più onorevole e prestigiosa. Lo stesso Federico II il Grande, re prussiano, gli offrì il posto di professore di chimica all'Università di Berlino. Rifiutando offerte così allettanti, Scheele ha detto: “Non posso mangiare più del necessario, e quello che guadagno qui a Köping mi basta per mangiare”.
Naturalmente, numerosi composti del cloro erano noti molto prima di Scheele. Questo elemento fa parte di molti sali, incluso il più famoso: il sale da cucina. Nel 1774, Scheele isolò il cloro in forma libera riscaldando la pirolusite minerale nera con acido cloridrico concentrato: MnO 2 + 4HCl ® Cl 2 + MnCl 2 + 2H 2 O.
Inizialmente, i chimici consideravano il cloro non come un elemento, ma come un composto chimico dell'elemento sconosciuto muria (dal latino muria - salamoia) con ossigeno. Si credeva che l'acido cloridrico (era chiamato acido murico) contenesse ossigeno legato chimicamente. Ciò è stato “testimoniato”, in particolare, dal fatto seguente: quando una soluzione di cloro era alla luce, da essa veniva rilasciato ossigeno e l'acido cloridrico rimaneva nella soluzione. Tuttavia, numerosi tentativi di “strappare” l’ossigeno dal cloro non hanno portato da nessuna parte. Pertanto, nessuno è riuscito a ottenere l'anidride carbonica riscaldando il cloro con il carbone (che, ad alte temperature, “toglie” ossigeno a molti composti che lo contengono). Come risultato di esperimenti simili condotti da Humphry Davy, Joseph Louis Gay-Lussac e Louis Jacques Thenard, divenne chiaro che il cloro non contiene ossigeno ed è una sostanza semplice. Alla stessa conclusione hanno portato gli esperimenti di Gay-Lussac, che ha analizzato il rapporto quantitativo dei gas nella reazione del cloro con l'idrogeno.
Nel 1811 Davy propose il nome “cloro” per il nuovo elemento, dal greco. "cloros" - giallo-verde. Questo è esattamente il colore del cloro. La stessa radice è nella parola "clorofilla" (dal greco "cloros" e "phyllon" - foglia). Un anno dopo, Gay-Lussac “accorciò” il nome in “cloro”. Ma ancora gli inglesi (e gli americani) chiamano questo elemento “cloro”, mentre i francesi lo chiamano cloro. Anche i tedeschi, “legislatori” della chimica per quasi tutto il XIX secolo, adottarono il nome abbreviato. (in tedesco il cloro è Chlor). Nel 1811, il fisico tedesco Johann Schweiger propose il nome "alogeno" per il cloro (dal greco "hals" - sale e "gennao" - partorire). Successivamente, questo termine fu assegnato non solo al cloro, ma anche a tutti i suoi analoghi nel settimo gruppo: fluoro, bromo, iodio, astato.
Interessante la dimostrazione della combustione dell'idrogeno in un'atmosfera di cloro: a volte durante l'esperimento si verifica un effetto collaterale insolito: si sente un ronzio. Molto spesso, la fiamma ronza quando un tubo sottile attraverso il quale viene fornito l'idrogeno viene abbassato in un recipiente a forma di cono pieno di cloro; lo stesso vale per i matracci sferici, ma nei cilindri la fiamma solitamente non ronza. Questo fenomeno era chiamato “fiamma che canta”.
In soluzione acquosa il cloro reagisce parzialmente e piuttosto lentamente con l'acqua; a 25° C, l'equilibrio: Cl 2 + H 2 O HClO + HCl si stabilisce entro due giorni. L'acido ipocloroso si decompone alla luce: HClO ® HCl + O. È l'ossigeno atomico a cui viene attribuito l'effetto sbiancante (il cloro assolutamente secco non ha questa capacità).
Il cloro nei suoi composti può presentare tutti gli stati di ossidazione, da –1 a +7. Con l'ossigeno, il cloro forma una serie di ossidi, tutti nella loro forma pura sono instabili ed esplosivi: Cl 2 O - gas giallo-arancione, ClO 2 - gas giallo (sotto i 9,7 o C - liquido rosso brillante), cloro perclorato Cl 2 O 4 (ClO –ClO 3, liquido giallo chiaro), Cl 2 O 6 (O 2 Cl–O–ClO 3, liquido rosso brillante), Cl 2 O 7 – liquido incolore, molto esplosivo. A basse temperature si ottenevano ossidi instabili Cl 2 O 3 e ClO 3. L'ossido di ClO 2 viene prodotto su scala industriale e viene utilizzato al posto del cloro per sbiancare la pasta e disinfettare l'acqua potabile e le acque reflue. Con altri alogeni, il cloro forma una serie di cosiddetti composti interalogeni, ad esempio ClF, ClF 3, ClF 5, BrCl, ICl, ICl 3.
Il cloro e i suoi composti con uno stato di ossidazione positivo sono forti agenti ossidanti. Nel 1822, il chimico tedesco Leopold Gmelin ottenne il sale rosso dal sale giallo del sangue mediante ossidazione con cloro: 2K 4 + Cl 2 ® K 3 + 2KCl. Il cloro ossida facilmente bromuri e cloruri, rilasciando bromo e iodio in forma libera.
Il cloro in diversi stati di ossidazione forma una serie di acidi: HCl - cloridrico (cloridrico, sali - cloruri), HClO - ipocloroso (sali - ipocloriti), HClO 2 - cloroso (sali - cloriti), HClO 3 - ipocloroso (sali - clorati) , HClO 4 – cloro (sali – perclorati). Tra gli acidi dell'ossigeno, solo l'acido perclorico è stabile nella sua forma pura. Tra i sali degli acidi dell'ossigeno, nell'uso pratico vengono utilizzati ipocloriti, clorito di sodio NaClO 2 - per candeggiare tessuti, per la produzione di fonti pirotecniche compatte di ossigeno ("candele ad ossigeno"), clorati di potassio (sale di Bertolometa), calcio e magnesio ( per il controllo dei parassiti agricoli, come componenti di composizioni pirotecniche ed esplosivi, nella produzione di fiammiferi), perclorati - componenti di esplosivi e composizioni pirotecniche; Il perclorato di ammonio è un componente dei combustibili solidi per missili.
Il cloro reagisce con molti composti organici. Si attacca rapidamente ai composti insaturi con doppi e tripli legami carbonio-carbonio (la reazione con l'acetilene procede in modo esplosivo) e alla luce al benzene. In determinate condizioni, il cloro può sostituire gli atomi di idrogeno nei composti organici: R–H + Cl 2 ® RCl + HCl. Questa reazione ha avuto un ruolo significativo nella storia della chimica organica. Nel 1840, il chimico francese Jean Baptiste Dumas scoprì che quando il cloro reagisce con l'acido acetico, la reazione avviene con sorprendente facilità
CH3COOH + Cl2® CH2ClCOOH + HCl. Con un eccesso di cloro si forma acido tricloroacetico CCl 3 COOH. Tuttavia, molti chimici erano diffidenti nei confronti del lavoro di Dumas. Infatti, secondo la teoria allora generalmente accettata di Berzelius, gli atomi di idrogeno caricati positivamente non potevano essere sostituiti da atomi di cloro caricati negativamente. Questa opinione era sostenuta a quel tempo da molti chimici eccezionali, tra cui Friedrich Wöhler, Justus Liebig e, naturalmente, lo stesso Berzelius.
Per ridicolizzare Dumas, Wöhler consegnò al suo amico Liebig un articolo per conto di un certo S. Windler (Schwindler - in tedesco un truffatore) su una nuova applicazione riuscita della reazione presumibilmente scoperta da Dumas. Nell'articolo Wöhler scriveva con evidente ironia come nell'acetato di manganese Mn(CH 3 COO) 2 fosse possibile sostituire tutti gli elementi, a seconda della loro valenza, con cloro, ottenendo una sostanza cristallina gialla costituita solo da cloro. È stato inoltre detto che in Inghilterra, sostituendo successivamente tutti gli atomi dei composti organici con atomi di cloro, i tessuti ordinari si trasformano in cloro, e che allo stesso tempo le cose mantengono il loro aspetto. In una nota a piè di pagina si affermava che i negozi londinesi svolgevano un vivace commercio di materiale costituito esclusivamente da cloro, poiché questo materiale era ottimo per berretti da notte e mutande calde.
La reazione del cloro con composti organici porta alla formazione di numerosi prodotti organoclorurati, tra cui i solventi ampiamente utilizzati cloruro di metilene CH 2 Cl 2, cloroformio CHCl 3, tetracloruro di carbonio CCl 4, tricloroetilene CHCl=CCl 2, tetracloroetilene C 2 Cl 4 . In presenza di umidità, il cloro scolorisce le foglie verdi delle piante e molti coloranti. Questo veniva utilizzato nel XVIII secolo. per il candeggio dei tessuti.
Cloro come gas velenoso.
Scheele, che ha ricevuto cloro, ha notato un odore forte molto sgradevole, difficoltà a respirare e tosse. Come abbiamo scoperto in seguito, una persona odora di cloro anche se un litro d'aria contiene solo 0,005 mg di questo gas, e allo stesso tempo ha già un effetto irritante sulle vie respiratorie, distruggendo le cellule della mucosa respiratoria tratto e polmoni. Una concentrazione di 0,012 mg/l è difficilmente tollerabile; se la concentrazione di cloro supera 0,1 mg/l, diventa pericoloso per la vita: la respirazione accelera, diventa convulsa, poi diventa sempre più rara e dopo 5-25 minuti la respirazione si ferma. La concentrazione massima consentita nell'aria delle imprese industriali è 0,001 mg/l e nell'aria delle aree residenziali - 0,00003 mg/l.
L'accademico di San Pietroburgo Toviy Egorovich Lovitz, ripetendo l'esperimento di Scheele nel 1790, rilasciò accidentalmente nell'aria una quantità significativa di cloro. Dopo averlo inalato, perse conoscenza e cadde, poi soffrì di dolori lancinanti al petto per otto giorni. Fortunatamente si è ripreso. Il famoso chimico inglese Davy quasi morì per avvelenamento da cloro. Gli esperimenti con quantità anche piccole di cloro sono pericolosi, poiché possono causare gravi danni ai polmoni. Si dice che il chimico tedesco Egon Wiberg abbia iniziato una delle sue conferenze sul cloro con le parole: “Il cloro è un gas velenoso. Se durante la prossima dimostrazione vengo avvelenato, per favore portatemi fuori all'aria aperta. Ma sfortunatamente la conferenza dovrà essere interrotta”. Se si rilascia molto cloro nell’aria diventa un vero disastro. Ciò fu sperimentato dalle truppe anglo-francesi durante la prima guerra mondiale. La mattina del 22 aprile 1915, il comando tedesco decise di effettuare il primo attacco con il gas nella storia delle guerre: quando il vento soffiò verso il nemico, su una piccola sezione di sei chilometri del fronte vicino alla città belga di Ypres , furono aperte contemporaneamente le valvole di 5.730 bombole, contenenti ciascuna 30 kg di cloro liquido. Nel giro di 5 minuti si formò un'enorme nuvola giallo-verde, che si allontanò lentamente dalle trincee tedesche verso gli Alleati. I soldati inglesi e francesi erano completamente indifesi. Il gas penetrava attraverso le fessure in tutti i rifugi; non c'era scampo: dopotutto la maschera antigas non era ancora stata inventata. Di conseguenza, 15mila persone furono avvelenate, 5mila delle quali morirono. Un mese dopo, il 31 maggio, i tedeschi ripeterono l’attacco con il gas sul fronte orientale, contro le truppe russe. Ciò è accaduto in Polonia vicino alla città di Bolimova. Sul fronte di 12 km, da 12mila bombole sono state rilasciate 264 tonnellate di una miscela di cloro e fosgene molto più tossico (cloruro di acido carbonico COCl 2). Il comando zarista sapeva cosa era successo a Ypres, eppure i soldati russi non avevano mezzi di difesa! A seguito dell'attacco con il gas, le perdite ammontarono a 9.146 persone, di cui solo 108 a causa dei bombardamenti di fucili e artiglieria, il resto fu avvelenato. Allo stesso tempo, morirono quasi immediatamente 1.183 persone.
Ben presto i chimici mostrarono come sfuggire al cloro: è necessario respirare attraverso una benda di garza imbevuta di una soluzione di tiosolfato di sodio (questa sostanza è usata in fotografia, spesso viene chiamata iposolfito). Il cloro reagisce molto rapidamente con una soluzione di tiosolfato, ossidandola:
Na2S2O3 + 4Cl2 + 5H2O® 2H2SO4 + 2NaCl + 6HCl. Naturalmente, anche l'acido solforico non è una sostanza innocua, ma la sua soluzione acquosa diluita è molto meno pericolosa del cloro velenoso. Pertanto, in quegli anni, il tiosolfato aveva un altro nome: "anticloro", ma le prime maschere antigas al tiosolfato non erano molto efficaci.
Nel 1916, il chimico russo e futuro accademico Nikolai Dmitrievich Zelinsky inventò una maschera antigas davvero efficace, in cui le sostanze tossiche venivano trattenute da uno strato di carbone attivo. Tale carbone con una superficie molto sviluppata potrebbe trattenere una quantità di cloro significativamente maggiore rispetto alla garza imbevuta di iposolfito. Fortunatamente gli “attacchi al cloro” sono rimasti solo un tragico episodio nella storia. Dopo la guerra mondiale al cloro rimasero solo professioni pacifiche.
Uso del cloro.
Ogni anno in tutto il mondo vengono prodotte enormi quantità di cloro: decine di milioni di tonnellate. Solo negli Stati Uniti entro la fine del XX secolo. Circa 12 milioni di tonnellate di cloro venivano prodotte ogni anno mediante elettrolisi (10° posto tra la produzione chimica). La maggior parte (fino al 50%) viene spesa per la clorazione di composti organici - per produrre solventi, gomma sintetica, cloruro di polivinile e altre materie plastiche, gomma cloroprene, pesticidi, medicinali e molti altri prodotti necessari e utili. Il resto viene consumato per la sintesi di cloruri inorganici, nell'industria della pasta e della carta per lo sbiancamento della pasta di legno e per la purificazione dell'acqua. Il cloro viene utilizzato in quantità relativamente piccole nell'industria metallurgica. Con il suo aiuto si ottengono metalli molto puri: titanio, stagno, tantalio, niobio. Bruciando l'idrogeno nel cloro si ottiene l'acido cloridrico e da esso si ottiene l'acido cloridrico. Il cloro viene utilizzato anche per la produzione di agenti sbiancanti (ipocloriti, candeggina) e per la disinfezione dell'acqua mediante clorazione.
Ilya Leenson
DEFINIZIONE
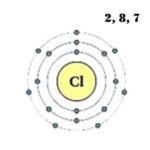
Cloro- il diciassettesimo elemento della tavola periodica. Designazione - Cl dal latino "clorum". Situato nel terzo periodo, gruppo VIIA. Si riferisce ai non metalli. La carica nucleare è 17.
Il composto naturale più importante del cloro è il cloruro di sodio (sale da cucina) NaCl. La massa principale di cloruro di sodio si trova nell'acqua dei mari e degli oceani. Anche le acque di molti laghi contengono quantità significative di NaCl. Si trova anche in forma solida, formando in alcuni punti della crosta terrestre spessi strati del cosiddetto salgemma. In natura sono comuni anche altri composti del cloro, ad esempio cloruro di potassio sotto forma di minerali carnallite KCl × MgCl 2 × 6H 2 O e silvite KCl.
In condizioni normali, il cloro è un gas giallo-verde (Fig. 1), altamente solubile in acqua. Una volta raffreddati, gli idrati cristallini vengono rilasciati da soluzioni acquose, che sono clarati della composizione approssimativa Cl 2 × 6H 2 O e Cl 2 × 8H 2 O.
Riso. 1. Cloro allo stato liquido. Aspetto.
Massa atomica e molecolare del cloro
La massa atomica relativa di un elemento è il rapporto tra la massa di un atomo di un dato elemento e 1/12 della massa di un atomo di carbonio. La massa atomica relativa è adimensionale ed è indicata con A r (l'indice “r” è la lettera iniziale della parola inglese relative, che significa “relativo”). La massa atomica relativa del cloro atomico è 35.457 amu.
Le masse delle molecole, così come le masse degli atomi, sono espresse in unità di massa atomica. La massa molecolare di una sostanza è la massa di una molecola, espressa in unità di massa atomica. La massa molecolare relativa di una sostanza è il rapporto tra la massa di una molecola di una determinata sostanza e 1/12 della massa di un atomo di carbonio, la cui massa è 12 amu. È noto che la molecola di cloro è biatomica - Cl 2. Il peso molecolare relativo di una molecola di cloro sarà uguale a:
Mr(Cl2) = 35,457 × 2 ≈ 71.
Isotopi del cloro
È noto che in natura il cloro si può trovare sotto forma di due isotopi stabili 35 Cl (75,78%) e 37 Cl (24,22%). I loro numeri di massa sono rispettivamente 35 e 37. Il nucleo di un atomo dell'isotopo del cloro 35 Cl contiene diciassette protoni e diciotto neutroni, e l'isotopo 37 Cl contiene lo stesso numero di protoni e venti neutroni.
Esistono isotopi artificiali del cloro con numero di massa da 35 a 43, tra i quali il più stabile è 36 Cl con un tempo di dimezzamento di 301 mila anni.
Ioni di cloro
Il livello energetico esterno dell'atomo di cloro ha sette elettroni, che sono elettroni di valenza:
1s 2 2s 2 2p 6 3s 2 3p 5 .
Come risultato dell’interazione chimica, il cloro può perdere i suoi elettroni di valenza, cioè essere il loro donatore e trasformarsi in ioni caricati positivamente o accettare elettroni da un altro atomo, ad es. essere il loro accettore e trasformarsi in ioni caricati negativamente:
Cl 0 -7e → Cl 7+ ;
Cl 0 -5e → Cl 5+ ;
Cl 0 -4e → Cl 4+ ;
Cl 0 -3e → Cl 3+ ;
Cl 0 -2e → Cl 2+ ;
Cl 0 -1e → Cl 1+ ;
Cl 0 +1e → Cl 1- .
Molecola e atomo di cloro
La molecola di cloro è composta da due atomi: Cl 2. Ecco alcune proprietà che caratterizzano l'atomo e la molecola del cloro:
Esempi di risoluzione dei problemi
ESEMPIO 1
| Esercizio | Quale volume di cloro deve essere preso per reagire con 10 litri di idrogeno? I gas sono nelle stesse condizioni. |
| Soluzione | Scriviamo l'equazione per la reazione tra cloro e idrogeno: Cl2 + H2 = 2HCl. Calcoliamo la quantità di sostanza idrogeno che ha reagito: n(H2) = V(H2) / Vm; n(H2) = 10/22,4 = 0,45 mol. Secondo l'equazione, n (H 2) = n (Cl 2) = 0,45 mol. Quindi, il volume di cloro che ha reagito con l'idrogeno è pari a: |
Vengono considerate le proprietà fisiche del cloro: la densità del cloro, la sua conduttività termica, il calore specifico e la viscosità dinamica a varie temperature. Le proprietà fisiche di Cl 2 sono presentate sotto forma di tabelle per gli stati liquido, solido e gassoso di questo alogeno.
Proprietà fisiche fondamentali del cloro
Il cloro è incluso nel gruppo VII del terzo periodo della tavola periodica degli elementi al numero 17. Appartiene al sottogruppo degli alogeni, ha masse atomiche e molecolari relative rispettivamente di 35.453 e 70.906. A temperature superiori a -30°C il cloro è un gas giallo-verdastro dal caratteristico odore forte e irritante. Si liquefa facilmente sotto pressione normale (1.013·10 5 Pa) quando raffreddato a -34°C e forma un liquido limpido ambrato che solidifica a -101°C.
A causa della sua elevata attività chimica, il cloro libero non si trova in natura, ma esiste solo sotto forma di composti. Si trova principalmente nel minerale salgemma (), e fa anche parte di minerali come la silvite (KCl), la carnallite (KCl MgCl 2 6H 2 O) e la silvinite (KCl NaCl). Il contenuto di cloro nella crosta terrestre si avvicina allo 0,02% del numero totale di atomi della crosta terrestre, dove si trova sotto forma di due isotopi 35 Cl e 37 Cl in un rapporto percentuale di 75,77% 35 Cl e 24,23% 37 Cl .
| Proprietà | Senso |
|---|---|
| Punto di fusione, °C | -100,5 |
| Punto di ebollizione, °C | -30,04 |
| Temperatura critica, °C | 144 |
| Pressione critica, Pa | 77,1105 |
| Densità critica, kg/m 3 | 573 |
| Densità del gas (a 0°C e 1.013 10 5 Pa), kg/m 3 | 3,214 |
| Densità del vapore saturo (a 0°C e 3.664 10 5 Pa), kg/m 3 | 12,08 |
| Densità del cloro liquido (a 0°C e 3.664 10 5 Pa), kg/m 3 | 1468 |
| Densità del cloro liquido (a 15,6°C e 6,08 10 5 Pa), kg/m 3 | 1422 |
| Densità del cloro solido (a -102°C), kg/m 3 | 1900 |
| Densità relativa del gas nell'aria (a 0°C e 1.013 10 5 Pa) | 2,482 |
| Densità relativa del vapore saturo nell'aria (a 0°C e 3.664 10 5 Pa) | 9,337 |
| Densità relativa del cloro liquido a 0°C (rispetto all'acqua a 4°C) | 1,468 |
| Volume specifico di gas (a 0°C e 1.013 10 5 Pa), m 3 /kg | 0,3116 |
| Volume specifico di vapore saturo (a 0°C e 3.664 10 5 Pa), m 3 /kg | 0,0828 |
| Volume specifico di cloro liquido (a 0°C e 3.664 10 5 Pa), m 3 /kg | 0,00068 |
| Pressione di vapore del cloro a 0°C, Pa | 3.664 10 5 |
| Viscosità dinamica del gas a 20°C, 10 -3 Pa s | 0,013 |
| Viscosità dinamica del cloro liquido a 20°C, 10 -3 Pa s | 0,345 |
| Calore di fusione del cloro solido (al punto di fusione), kJ/kg | 90,3 |
| Calore di vaporizzazione (al punto di ebollizione), kJ/kg | 288 |
| Calore di sublimazione (al punto di fusione), kJ/mol | 29,16 |
| Capacità termica molare C p del gas (a -73…5727°C), J/(mol K) | 31,7…40,6 |
| Capacità termica molare C p del cloro liquido (a -101…-34°C), J/(mol K) | 67,1…65,7 |
| Coefficiente di conducibilità termica del gas a 0°C, W/(m K) | 0,008 |
| Coefficiente di conducibilità termica del cloro liquido a 30°C, W/(m K) | 0,62 |
| Entalpia del gas, kJ/kg | 1,377 |
| Entalpia del vapore saturo, kJ/kg | 1,306 |
| Entalpia del cloro liquido, kJ/kg | 0,879 |
| Indice di rifrazione a 14°C | 1,367 |
| Conducibilità elettrica specifica a -70°С, S/m | 10 -18 |
| Affinità elettronica, kJ/mol | 357 |
| Energia di ionizzazione, kJ/mol | 1260 |
Densità del cloro
In condizioni normali il cloro è un gas pesante con una densità circa 2,5 volte superiore. Densità del cloro gassoso e liquido in condizioni normali (a 0°C) è pari rispettivamente a 3,214 e 1468 kg/m3. Quando il cloro liquido o gassoso viene riscaldato, la sua densità diminuisce a causa dell'aumento di volume dovuto alla dilatazione termica.
Densità del cloro gassoso
Nella tabella è riportata la densità del cloro allo stato gassoso a diverse temperature (da -30 a 140°C) e alla normale pressione atmosferica (1.013·10 5 Pa). La densità del cloro cambia con la temperatura: diminuisce quando viene riscaldata. Per esempio, a 20°C la densità del cloro è 2,985 kg/m3, e quando la temperatura di questo gas aumenta fino a 100°C, il valore della densità diminuisce fino al valore di 2,328 kg/m 3.
| t, °С | ρ, kg/m3 | t, °С | ρ, kg/m3 |
|---|---|---|---|
| -30 | 3,722 | 60 | 2,616 |
| -20 | 3,502 | 70 | 2,538 |
| -10 | 3,347 | 80 | 2,464 |
| 0 | 3,214 | 90 | 2,394 |
| 10 | 3,095 | 100 | 2,328 |
| 20 | 2,985 | 110 | 2,266 |
| 30 | 2,884 | 120 | 2,207 |
| 40 | 2,789 | 130 | 2,15 |
| 50 | 2,7 | 140 | 2,097 |
All’aumentare della pressione, aumenta la densità del cloro. Le tabelle seguenti mostrano la densità del cloro gassoso nell'intervallo di temperatura da -40 a 140°C e pressione da 26,6·10 5 a 213·10 5 Pa. All'aumentare della pressione, la densità del cloro allo stato gassoso aumenta proporzionalmente. Ad esempio, un aumento della pressione del cloro da 53,2·10 5 a 106,4·10 5 Pa ad una temperatura di 10°C porta ad un duplice aumento della densità di questo gas.
| ↓ t, °С | P, kPa → | 26,6 | 53,2 | 79,8 | 101,3 |
|---|---|---|---|---|
| -40 | 0,9819 | 1,996 | — | — |
| -30 | 0,9402 | 1,896 | 2,885 | 3,722 |
| -20 | 0,9024 | 1,815 | 2,743 | 3,502 |
| -10 | 0,8678 | 1,743 | 2,629 | 3,347 |
| 0 | 0,8358 | 1,678 | 2,528 | 3,214 |
| 10 | 0,8061 | 1,618 | 2,435 | 3,095 |
| 20 | 0,7783 | 1,563 | 2,35 | 2,985 |
| 30 | 0,7524 | 1,509 | 2,271 | 2,884 |
| 40 | 0,7282 | 1,46 | 2,197 | 2,789 |
| 50 | 0,7055 | 1,415 | 2,127 | 2,7 |
| 60 | 0,6842 | 1,371 | 2,062 | 2,616 |
| 70 | 0,6641 | 1,331 | 2 | 2,538 |
| 80 | 0,6451 | 1,292 | 1,942 | 2,464 |
| 90 | 0,6272 | 1,256 | 1,888 | 2,394 |
| 100 | 0,6103 | 1,222 | 1,836 | 2,328 |
| 110 | 0,5943 | 1,19 | 1,787 | 2,266 |
| 120 | 0,579 | 1,159 | 1,741 | 2,207 |
| 130 | 0,5646 | 1,13 | 1,697 | 2,15 |
| 140 | 0,5508 | 1,102 | 1,655 | 2,097 |
| ↓ t, °С | P, kPa → | 133 | 160 | 186 | 213 |
|---|---|---|---|---|
| -20 | 4,695 | 5,768 | — | — |
| -10 | 4,446 | 5,389 | 6,366 | 7,389 |
| 0 | 4,255 | 5,138 | 6,036 | 6,954 |
| 10 | 4,092 | 4,933 | 5,783 | 6,645 |
| 20 | 3,945 | 4,751 | 5,565 | 6,385 |
| 30 | 3,809 | 4,585 | 5,367 | 6,154 |
| 40 | 3,682 | 4,431 | 5,184 | 5,942 |
| 50 | 3,563 | 4,287 | 5,014 | 5,745 |
| 60 | 3,452 | 4,151 | 4,855 | 5,561 |
| 70 | 3,347 | 4,025 | 4,705 | 5,388 |
| 80 | 3,248 | 3,905 | 4,564 | 5,225 |
| 90 | 3,156 | 3,793 | 4,432 | 5,073 |
| 100 | 3,068 | 3,687 | 4,307 | 4,929 |
| 110 | 2,985 | 3,587 | 4,189 | 4,793 |
| 120 | 2,907 | 3,492 | 4,078 | 4,665 |
| 130 | 2,832 | 3,397 | 3,972 | 4,543 |
| 140 | 2,761 | 3,319 | 3,87 | 4,426 |
Densità del cloro liquido
Il cloro liquido può esistere in un intervallo di temperature relativamente ristretto, i cui confini vanno da meno 100,5 a più 144 ° C (cioè dal punto di fusione alla temperatura critica). Al di sopra di una temperatura di 144°C, il cloro non passa allo stato liquido sotto nessuna pressione. La densità del cloro liquido in questo intervallo di temperature varia da 1717 a 573 kg/m3.
| t, °С | ρ, kg/m3 | t, °С | ρ, kg/m3 |
|---|---|---|---|
| -100 | 1717 | 30 | 1377 |
| -90 | 1694 | 40 | 1344 |
| -80 | 1673 | 50 | 1310 |
| -70 | 1646 | 60 | 1275 |
| -60 | 1622 | 70 | 1240 |
| -50 | 1598 | 80 | 1199 |
| -40 | 1574 | 90 | 1156 |
| -30 | 1550 | 100 | 1109 |
| -20 | 1524 | 110 | 1059 |
| -10 | 1496 | 120 | 998 |
| 0 | 1468 | 130 | 920 |
| 10 | 1438 | 140 | 750 |
| 20 | 1408 | 144 | 573 |
Capacità termica specifica del cloro
La capacità termica specifica del cloro gassoso C p in kJ/(kg K) nell'intervallo di temperatura da 0 a 1200°C e pressione atmosferica normale può essere calcolata utilizzando la formula:
dove T è la temperatura assoluta del cloro in gradi Kelvin.
Va notato che in condizioni normali la capacità termica specifica del cloro è 471 J/(kg K) e aumenta quando riscaldato. L'aumento della capacità termica a temperature superiori a 500°C diventa insignificante, e ad alte temperature il calore specifico del cloro rimane praticamente invariato.
La tabella mostra i risultati del calcolo del calore specifico del cloro utilizzando la formula sopra (l'errore di calcolo è di circa l'1%).
| t, °С | C p , J/(kg·K) | t, °С | C p , J/(kg·K) |
|---|---|---|---|
| 0 | 471 | 250 | 506 |
| 10 | 474 | 300 | 508 |
| 20 | 477 | 350 | 510 |
| 30 | 480 | 400 | 511 |
| 40 | 482 | 450 | 512 |
| 50 | 485 | 500 | 513 |
| 60 | 487 | 550 | 514 |
| 70 | 488 | 600 | 514 |
| 80 | 490 | 650 | 515 |
| 90 | 492 | 700 | 515 |
| 100 | 493 | 750 | 515 |
| 110 | 494 | 800 | 516 |
| 120 | 496 | 850 | 516 |
| 130 | 497 | 900 | 516 |
| 140 | 498 | 950 | 516 |
| 150 | 499 | 1000 | 517 |
| 200 | 503 | 1100 | 517 |
A temperature prossime allo zero assoluto, il cloro è allo stato solido e ha un basso potere calorifico specifico (19 J/(kg K)). All'aumentare della temperatura del Cl 2 solido, la sua capacità termica aumenta e raggiunge il valore di 720 J/(kg K) a meno 143°C.
Il cloro liquido ha una capacità termica specifica di 918...949 J/(kg K) nell'intervallo da 0 a -90 gradi Celsius. La tabella mostra che la capacità termica specifica del cloro liquido è superiore a quella del cloro gassoso e diminuisce con l'aumentare della temperatura.
Conduttività termica del cloro
Nella tabella sono riportati i valori dei coefficienti di conducibilità termica del cloro gassoso alla normale pressione atmosferica nell'intervallo di temperatura da -70 a 400°C.
Il coefficiente di conduttività termica del cloro in condizioni normali è 0,0079 W/(m°), ovvero 3 volte inferiore rispetto alla stessa temperatura e pressione. Il riscaldamento del cloro porta ad un aumento della sua conduttività termica. Pertanto, alla temperatura di 100°C, il valore di questa proprietà fisica del cloro aumenta a 0,0114 W/(m deg).
| t, °С | λ, W/(m gradi) | t, °С | λ, W/(m gradi) |
|---|---|---|---|
| -70 | 0,0054 | 50 | 0,0096 |
| -60 | 0,0058 | 60 | 0,01 |
| -50 | 0,0062 | 70 | 0,0104 |
| -40 | 0,0065 | 80 | 0,0107 |
| -30 | 0,0068 | 90 | 0,0111 |
| -20 | 0,0072 | 100 | 0,0114 |
| -10 | 0,0076 | 150 | 0,0133 |
| 0 | 0,0079 | 200 | 0,0149 |
| 10 | 0,0082 | 250 | 0,0165 |
| 20 | 0,0086 | 300 | 0,018 |
| 30 | 0,009 | 350 | 0,0195 |
| 40 | 0,0093 | 400 | 0,0207 |
Viscosità del cloro
Il coefficiente di viscosità dinamica del cloro gassoso nell'intervallo di temperatura 20...500°C può essere calcolato approssimativamente utilizzando la formula:
dove η T è il coefficiente di viscosità dinamica del cloro ad una data temperatura T, K;
η T 0 - coefficiente di viscosità dinamica del cloro alla temperatura T 0 = 273 K (in condizioni normali);
C è la costante di Sutherland (per il cloro C = 351).
In condizioni normali, la viscosità dinamica del cloro è 0,0123·10 -3 Pa·s. Quando riscaldato, la proprietà fisica del cloro, come la viscosità, assume valori più elevati.
Il cloro liquido ha una viscosità di un ordine di grandezza superiore rispetto al cloro gassoso. Ad esempio, alla temperatura di 20°C, la viscosità dinamica del cloro liquido ha un valore di 0,345·10 -3 Pa·s e diminuisce con l'aumentare della temperatura.
Fonti:
- Barkov S. A. Alogeni e sottogruppo del manganese. Elementi del gruppo VII della tavola periodica di D. I. Mendeleev. Un manuale per gli studenti. M.: Educazione, 1976 - 112 p.
- Tabelle delle grandezze fisiche. Direttorio. Ed. acad. IK Kikoina. M.: Atomizdat, 1976 - 1008 p.
- Yakimenko L. M., Pasmanik M. I. Manuale sulla produzione di cloro, soda caustica e prodotti basici a base di cloro. Ed. 2°, p. e altri M.: Chimica, 1976 - 440 p.
Il cloro fu ottenuto per la prima volta nel 1772 da Scheele, che ne descrisse il rilascio durante l'interazione della pirolusite con l'acido cloridrico nel suo trattato sulla pirolusite: 4HCl + MnO 2 = Cl 2 + MnCl 2 + 2H 2 O
Scheele notò l'odore del cloro, simile a quello dell'acqua regia, la sua capacità di reagire con l'oro e il cinabro e le sue proprietà sbiancanti. Tuttavia, Scheele, in accordo con la teoria del flogisto allora dominante nella chimica, suggerì che il cloro fosse acido cloridrico deflogistico, cioè l'ossido dell'acido cloridrico.
Berthollet e Lavoisier suggerirono che il cloro fosse un ossido dell'elemento muria, ma i tentativi di isolarlo non ebbero successo fino al lavoro di Davy, che riuscì a decomporre il sale da cucina in sodio e cloro mediante elettrolisi.
Il nome dell'elemento deriva dal greco clwroz- "verde".
Essere nella natura, ricevere:
Il cloro naturale è una miscela di due isotopi 35 Cl e 37 Cl. Nella crosta terrestre, il cloro è l'alogeno più comune. Poiché il cloro è molto attivo, in natura si trova solo sotto forma di composti nei minerali: salgemma NaCl, silvite KCl, silvinite KCl NaCl, bischofite MgCl 2 6H 2 O, carnallite KCl MgCl 2 6H 2 O, kainite KCl MgSO 4 · 3H 2 O. Le maggiori riserve di cloro sono contenute nei sali delle acque dei mari e degli oceani.
Su scala industriale, il cloro viene prodotto insieme all'idrossido di sodio e all'idrogeno attraverso l'elettrolisi di una soluzione di sale da cucina:
2NaCl + 2H 2 O => H 2 + Cl 2 + 2NaOH
Per recuperare il cloro dall'acido cloridrico, che è un sottoprodotto della clorazione industriale dei composti organici, si utilizza il processo Deacon (ossidazione catalitica dell'acido cloridrico con l'ossigeno atmosferico):
4HCl + O2 = 2H2O + 2Cl2
I processi solitamente utilizzati nei laboratori si basano sull'ossidazione dell'acido cloridrico con forti agenti ossidanti (ad esempio ossido di manganese (IV), permanganato di potassio, dicromato di potassio):
2KMnO4 + 16HCl = 5Cl2 + 2MnCl2 + 2KCl +8H2O
K2Cr2O7 + 14HCl = 3Cl2 + 2CrCl3 + 2KCl + 7H2O
Proprietà fisiche:
In condizioni normali, il cloro è un gas giallo-verde con un odore soffocante. Il cloro è notevolmente solubile in acqua ("acqua clorata"). A 20°C, 2,3 volumi di cloro si sciolgono in un volume d'acqua. Punto di ebollizione = -34°C; punto di fusione = -101°C, densità (gas, n.s.) = 3,214 g/l.
Proprietà chimiche:
Il cloro è molto attivo: si combina direttamente con quasi tutti gli elementi della tavola periodica, metalli e non metalli (eccetto carbonio, azoto, ossigeno e gas inerti). Il cloro è un agente ossidante molto forte, che sostituisce i non metalli meno attivi (bromo, iodio) dai loro composti con idrogeno e metalli:
Cl2 + 2HBr = Br2 + 2HCl; Cl2 + 2NaI = I2 + 2NaCl
Quando disciolto in acqua o alcali, il cloro si dismuta, formando acido ipocloroso (e quando riscaldato, perclorico) e acido cloridrico, o loro sali.
Cl2+H2OHClO+HCl;
Il cloro interagisce con molti composti organici, entrando in reazioni di sostituzione o addizione:
CH 3 -CH 3 + xCl 2 => C 2 H 6-x Cl x + xHCl
CH2 =CH2 + Cl2 => Cl-CH2 -CH2 -Cl
C6H6+Cl2 => C6H6Cl+HCl
Il cloro ha sette stati di ossidazione: -1, 0, +1, +3, +4, +5, +7.
I collegamenti più importanti:
Cloruro di idrogeno HCl- un gas incolore che fuma nell'aria a causa della formazione di goccioline di nebbia con vapore acqueo. Ha un odore pungente e irrita gravemente le vie respiratorie. Contenuto nei gas e nelle acque vulcaniche, nel succo gastrico. Le proprietà chimiche dipendono dallo stato in cui si trova (può essere allo stato gassoso, liquido o di soluzione). Si chiama la soluzione HCl acido cloridrico. È un acido forte e sposta gli acidi più deboli dai loro sali. Sali - cloruri- sostanze solide cristalline con punti di fusione elevati.
Cloruri covalenti- composti del cloro con non metalli, gas, liquidi o solidi fusibili che hanno caratteristiche proprietà acide, solitamente facilmente idrolizzati dall'acqua per formare acido cloridrico:
PCl5 + 4H2O = H3PO4 + 5HCl;
Ossido di cloro(I) Cl2O., un gas di colore giallo-brunastro con odore pungente. Colpisce gli organi respiratori. Si dissolve facilmente in acqua formando acido ipocloroso.
Acido ipocloroso HClO. Esiste solo nelle soluzioni. È un acido debole e instabile. Si decompone facilmente in acido cloridrico e ossigeno. Forte agente ossidante. Si forma quando il cloro si dissolve in acqua. Sali - ipocloriti, bassa stabilità (NaClO*H 2 O si decompone in modo esplosivo a 70 °C), forti agenti ossidanti. Ampiamente usato per lo sbiancamento e la disinfezione polvere decolorante, sale misto Ca(Cl)OCl
Acido cloroso HClO2, nella sua forma libera è instabile, anche in soluzione acquosa diluita si decompone rapidamente. Acidi di media forza, sali - cloriti, di regola, sono incolori e altamente solubili in acqua. A differenza degli ipocloriti, i cloriti presentano proprietà ossidanti pronunciate solo in un ambiente acido. L'uso maggiore (per candeggiare tessuti e pasta di carta) è il clorito di sodio NaClO 2.
Ossido di cloro (IV) ClO 2, è un gas giallo-verdastro con odore sgradevole (pungente), ...
Acido clorico, HClO 3 - nella sua forma libera è instabile: è sproporzionato in ClO 2 e HClO 4. Sali - clorati; Di questi, i più importanti sono i clorati di sodio, potassio, calcio e magnesio. Questi sono forti agenti ossidanti e sono esplosivi se miscelati con agenti riducenti. Clorato di potassio ( Il sale di Berthollet) - KClO 3, veniva utilizzato per produrre ossigeno in laboratorio, ma a causa della sua elevata pericolosità non veniva più utilizzato. Soluzioni di clorato di potassio venivano usate come antisettico debole e gargarismi medicinali esterni.
Acido perclorico HClO4, nelle soluzioni acquose, l'acido perclorico è il più stabile di tutti gli acidi cloro contenenti ossigeno. L'acido perclorico anidro, ottenuto utilizzando acido solforico concentrato dal 72% di HClO 4, non è molto stabile. È l'acido monoprotico più forte (in soluzione acquosa). Sali - perclorati, sono usati come ossidanti (motori a razzo a propellente solido).
Applicazione:
Il cloro è utilizzato in molti settori, nella scienza e nelle esigenze domestiche:
- Nella produzione di cloruro di polivinile, composti plastici, gomma sintetica;
- Per il candeggio di tessuti e carta;
- Produzione di insetticidi organoclorurati - sostanze che uccidono gli insetti dannosi per le colture, ma sono sicure per le piante;
- Per la disinfezione dell'acqua - “clorazione”;
- Registrato nell'industria alimentare come additivo alimentare E925;
- Nella produzione chimica di acido cloridrico, candeggina, sale di Berthollet, cloruri metallici, veleni, farmaci, fertilizzanti;
- In metallurgia per la produzione di metalli puri: titanio, stagno, tantalio, niobio.
Ruolo biologico e tossicità:
Il cloro è uno degli elementi biogenici più importanti e fa parte di tutti gli organismi viventi. Negli animali e nell'uomo, gli ioni cloro sono coinvolti nel mantenimento dell'equilibrio osmotico; lo ione cloruro ha un raggio ottimale per penetrare attraverso la membrana cellulare. Gli ioni cloro sono vitali per le piante, partecipano al metabolismo energetico nelle piante, attivando la fosforilazione ossidativa.
Il cloro sotto forma di sostanza semplice è velenoso; se entra nei polmoni provoca ustioni ai tessuti polmonari e soffocamento. Ha un effetto irritante sulle vie respiratorie ad una concentrazione nell'aria di circa 0,006 mg/l (cioè il doppio della soglia per la percezione dell'odore di cloro). Il cloro fu uno dei primi agenti chimici utilizzati dalla Germania durante la prima guerra mondiale.
Korotkova Y., Shvetsova I.
HF Tyumen State University, gruppo 571.
Fonti: Wikipedia: http://ru.wikipedia.org/wiki/Cl, ecc.,
Sito web dell'Università tecnica chimica russa che porta il nome. DI Mendeleev:
Caratteristiche degli elementi del gruppo VII del sottogruppo principale, utilizzando come esempio il cloro
Caratteristiche generali del sottogruppo
Tabella 1. Nomenclatura degli elementi del sottogruppo VIIA
Elementi P, tipici, non metalli (l'astato è un semimetallo), alogeni.
Diagramma elettronico dell'elemento Hal (Hal ≠ F):
Gli elementi del sottogruppo VIIA sono caratterizzati dalle seguenti valenze:
Tabella 2. Valenza
3. Gli elementi del sottogruppo VIIA sono caratterizzati dai seguenti stati di ossidazione:
Tabella 3. Stati di ossidazione degli elementi
Caratteristiche di un elemento chimico
Il cloro è un elemento del gruppo VII A. Numero di serie 17
Massa atomica relativa: 35,4527 a. e.m. (g/mol)
 Numero di protoni, neutroni, elettroni: 17,18,17
Numero di protoni, neutroni, elettroni: 17,18,17
Struttura atomica:
![]()
Formula elettronica:
Stati di ossidazione tipici: -1, 0, +1, +3, +4, +5, +7
Energia di ionizzazione: 1254,9(13,01) kJ/mol (eV)
Affinità elettronica: 349 (kJ/mol)
Elettronegatività secondo Pauling: 3.20
Caratteristiche di una sostanza semplice
Tipo di legame: covalente non polare
Molecola biatomica
Isotopi: 35 Cl (75,78%) e 37 Cl (24,22%)
Tipo di reticolo cristallino: molecolare
Parametri termodinamici
Tabella 4
Proprietà fisiche
Tabella 5
Proprietà chimiche
Una soluzione acquosa di cloro è altamente dismutata (“acqua clorata”)
Fase 1: Cl2 + H2O = HCl + HOCl
Stadio 2: HOCl = HCl + [O] – ossigeno atomico
La capacità ossidante nel sottogruppo diminuisce da fluoro a iodio = ˃
Il cloro è un forte agente ossidante:
1. Interazione con sostanze semplici
a) con idrogeno:
Cl2 + H2 = 2HCl
b) con metalli:
Cl2 + 2Na = 2NaCl
3Cl2 + 2Fe = 2FeCl3
c) con alcuni non metalli meno elettronegativi:
3Cl2 + 2P = 2PCl3
Cl2 + S = SCl2
Con ossigeno, carbonio e azoto, cloro direttamente non reagisce!
2. Interazione con sostanze complesse
a) con acqua: vedi sopra
b) con acidi: non reagisce!
c) con soluzioni alcaline:
al freddo: Cl 2 +2 NaOH = NaCl + NaClO + H 2 O
quando riscaldato: 3Cl 2 + 6 KOH = 5KCl + KClO 3 + 3H 2 O
e) con molte sostanze organiche:
Cl2 + CH4 = CH3Cl + HCl
C6H6 + Cl2 = C6H5Cl + HCl
I più importanti composti del cloro
 Cloruro di idrogeno, acido cloridrico(HCl) è un gas incolore, termicamente stabile (in condizioni normali) con un odore pungente, vapori nell'aria umida, si dissolve facilmente in acqua (fino a 500 volumi di gas per volume di acqua) per formare acido cloridrico (cloridrico). A -114,22 °C, l'HCl passa allo stato solido. Allo stato solido, l'acido cloridrico esiste sotto forma di due modifiche cristalline: ortorombica, stabile sotto e cubica.
Cloruro di idrogeno, acido cloridrico(HCl) è un gas incolore, termicamente stabile (in condizioni normali) con un odore pungente, vapori nell'aria umida, si dissolve facilmente in acqua (fino a 500 volumi di gas per volume di acqua) per formare acido cloridrico (cloridrico). A -114,22 °C, l'HCl passa allo stato solido. Allo stato solido, l'acido cloridrico esiste sotto forma di due modifiche cristalline: ortorombica, stabile sotto e cubica.
Una soluzione acquosa di acido cloridrico è chiamata acido cloridrico. Quando disciolto in acqua, si verificano i seguenti processi:
HCl g + H 2 O l = H 3 O + l + Cl − l
Il processo di dissoluzione è altamente esotermico. Con l'acqua l'HCl forma una miscela azeotropica. È un acido monoprotico forte. Interagisce energeticamente con tutti i metalli nella serie di tensioni a sinistra dell'idrogeno, con ossidi, basi e sali basici e anfoteri, formando sali - cloruri:
Mg + 2HCl → MgCl2 + H2
FeO + 2HCl → FeCl2 + H2O
Se esposto a forti agenti ossidanti o durante l'elettrolisi, l'acido cloridrico mostra proprietà riducenti:
MnO2 + 4 HCl → MnCl2 + Cl2 + 2 H2O
Quando riscaldato, l'acido cloridrico viene ossidato dall'ossigeno (catalizzatore - cloruro di rame (II) CuCl 2):
4 HCl + O 2 → 2 H 2 O +2 Cl 2
Tuttavia, l'acido cloridrico concentrato reagisce con il rame per formare un complesso di rame monovalente:
2 Cu + 4 HCl → 2 H + H 2
Una miscela di 3 parti in volume di acido cloridrico concentrato e 1 parte in volume di acido nitrico concentrato è chiamata “acqua regia”. L'acqua regia può persino sciogliere l'oro e il platino. L'elevata attività ossidativa dell'acqua regia è dovuta alla presenza in essa di cloruro di nitrosile e cloro, che sono in equilibrio con le sostanze di partenza:
4 H 3 O + + 3 Cl − + NO 3 − = NOCl + Cl 2 + 6 H 2 O
A causa dell'elevata concentrazione di ioni cloruro nella soluzione, il metallo si lega in un complesso cloruro, che ne favorisce la dissoluzione:
3 Pt + 4 HNO 3 + 18 HCl → 3 H 2 + 4 NO + 8 H 2 O
L'acido cloridrico è anche caratterizzato da reazioni di addizione a legami multipli (addizione elettrofila):
R-CH=CH2 + HCl → R-CHCl-CH3
R-C≡CH + 2 HCl → R-CCl 2 -CH 3
Ossidi di cloro- composti chimici inorganici del cloro e dell'ossigeno, con la formula generale: Cl x O y.
Il cloro forma i seguenti ossidi: Cl 2 O, Cl 2 O 3, ClO 2, Cl 2 O 4, Cl 2 O 6, Cl 2 O 7. Inoltre, sono noti: il radicale di breve durata ClO, il radicale perossido di cloro ClOO e il radicale tetrossido di cloro ClO 4 .
La tabella seguente mostra le proprietà degli ossidi di cloro stabili:
Tabella 6
| Proprietà | Cl2O | ClO2 | ClOClO3 | Cl2O6 (l)↔2ClO3 (g) | Cl2O7 |
| Colore e condizioni della stanza. temperatura | Gas giallo-marrone | Gas giallo-verde | Liquido giallo chiaro | Liquido rosso scuro | Liquido incolore |
| Stato di ossidazione del cloro | (+1) | (+4) | (+1), (+7) | (+6) | (+7) |
| T.pl., °C | −120,6 | −59 | −117 | 3,5 | −91,5 |
| Temperatura di ebollizione, °C | 2,0 | 44,5 | |||
| D(f, 0°C), g*cm -3 | - | 1,64 | 1,806 | - | 2,02 |
| Campione ΔH° (gas, 298 K), kJ*mol -1 | 80,3 | 102,6 | ~180 | (155) | |
| Campione ΔG° (gas, 298 K), kJ*mol -1 | 97,9 | 120,6 | - | - | - |
| Campione S° (gas, 298 K), J*K -1 *mol -1 | 265,9 | 256,7 | 327,2 | - | - |
| Momento dipolare μ, D | 0,78 ± 0,08 | 1,78 ± 0,01 | - | - | 0,72 ± 0,02 |
 Ossido di cloro (I), Ossido di dicloro, anidride dell'acido ipocloroso - un composto di cloro nello stato di ossidazione +1 con ossigeno.
Ossido di cloro (I), Ossido di dicloro, anidride dell'acido ipocloroso - un composto di cloro nello stato di ossidazione +1 con ossigeno.
In condizioni normali è un gas giallo-brunastro con un odore caratteristico che ricorda il cloro. A temperature inferiori a 2 °C il liquido è di colore rosso dorato. Tossico: colpisce le vie respiratorie. Si decompone spontaneamente e lentamente:
Esplosivo ad alte concentrazioni. La densità in condizioni normali è 3,22 kg/m³. Si dissolve in tetracloruro di carbonio. Solubile in acqua per formare acido ipocloroso debole:
Reagisce rapidamente con gli alcali:
Cl2O + 2NaOH (dil.) = 2NaClO + H2O
Biossido di cloro-ossido acido. Quando disciolto in acqua si formano acidi clorosi e perclorici (reazione di sproporzione). Le soluzioni diluite sono stabili al buio e si decompongono lentamente alla luce:
 Biossido di cloro- ossido di cloro ( IV), un composto di cloro e ossigeno, formula: ClO 2.
Biossido di cloro- ossido di cloro ( IV), un composto di cloro e ossigeno, formula: ClO 2.
In condizioni normali, ClO 2 è un gas giallo-rossastro con un odore caratteristico. A temperature inferiori a 10 °C ClO 2 è un liquido rosso-marrone. Bassa stabilità, esplode alla luce, a contatto con agenti ossidanti e se riscaldato. Sciogliamolo bene in acqua. A causa del suo rischio esplosivo, il biossido di cloro non può essere conservato allo stato liquido.
Ossido acido. Quando disciolto in acqua si formano acidi clorosi e perclorici (reazione di sproporzione). Le soluzioni diluite sono stabili al buio e si decompongono lentamente alla luce:
L'acido cloroso risultante è molto instabile e si decompone:
Presenta proprietà redox.
2ClO 2 + 5H 2 SO 4 (diluito) + 10FeSO 4 = 5Fe 2 (SO 4) 3 + 2HCl + 4H 2 O
ClO2 + 2NaOH freddo. = NaClO2 + NaClO3 + H2O
ClO2 + O3 = ClO3 + O2
ClO 2 reagisce con molti composti organici e agisce come un agente ossidante di media forza.
 Acido ipocloroso- HClO, un acido monoprotico molto debole in cui il cloro ha uno stato di ossidazione +1. Esiste solo nelle soluzioni.
Acido ipocloroso- HClO, un acido monoprotico molto debole in cui il cloro ha uno stato di ossidazione +1. Esiste solo nelle soluzioni.
Nelle soluzioni acquose, l'acido ipocloroso si decompone parzialmente in un protone e nell'anione ipoclorito ClO −:
Instabile. Acido ipocloroso e suoi sali - ipocloriti- forti agenti ossidanti. Reagisce con l'acido cloridrico HCl, formando cloro molecolare:
HClO + NaOH (diluito) = NaClO + H 2 O 
Acido cloroso- HClO 2, un acido monobasico di media forza.
L'acido cloroso HClO 2 nella sua forma libera è instabile; anche in una soluzione acquosa diluita si decompone rapidamente:
Neutralizzato dagli alcali.
HClO 2 + NaOH (dil. freddo) = NaClO 2 + H 2 O
L'anidride di questo acido è sconosciuta.
Dai suoi sali si prepara una soluzione acida - cloriti formato come risultato dell'interazione di ClO 2 con gli alcali:
Presenta proprietà redox.
5HClO2 + 3H2SO4 (diluito) + 2KMnO4 = 5HClO3 + 2MnSO4 + K2SO4 + 3H2O
 Acido clorico- HClO 3, un acido monobasico forte in cui il cloro ha uno stato di ossidazione +5. Non ricevuto in forma gratuita; in soluzioni acquose a concentrazioni inferiori al 30% al freddo è abbastanza stabile; in soluzioni più concentrate si decompone:
Acido clorico- HClO 3, un acido monobasico forte in cui il cloro ha uno stato di ossidazione +5. Non ricevuto in forma gratuita; in soluzioni acquose a concentrazioni inferiori al 30% al freddo è abbastanza stabile; in soluzioni più concentrate si decompone:
L'acido ipocloroso è un forte agente ossidante; la capacità ossidante aumenta con l’aumentare della concentrazione e della temperatura. HClO 3 viene facilmente ridotto ad acido cloridrico:
HClO 3 + 5HCl (conc.) = 3Cl 2 + 3H 2 O
HClO 3 + NaOH (diluito) = NaClO 3 + H 2 O
Quando una miscela di SO 2 e aria viene fatta passare attraverso una soluzione fortemente acida, si forma biossido di cloro:
Nell'acido perclorico al 40%, ad esempio, la carta da filtro si accende.
8. Essere nella natura:
Nella crosta terrestre, il cloro è l'alogeno più comune. Poiché il cloro è molto attivo, si trova in natura solo sotto forma di composti minerali.
Tabella 7. Ritrovamento in natura
Tabella 7. Forme minerali
Le maggiori riserve di cloro sono contenute nei sali delle acque dei mari e degli oceani.
Ricevuta
I metodi chimici per produrre cloro sono inefficaci e costosi. Oggi hanno soprattutto un significato storico. Può essere ottenuto facendo reagire il permanganato di potassio con acido cloridrico:
Metodo Scheele
Inizialmente il metodo industriale per produrre cloro si basava sul metodo Scheele, cioè sulla reazione della pirolusite con acido cloridrico:
Metodo del diacono
Metodo per la produzione di cloro mediante ossidazione catalitica dell'acido cloridrico con ossigeno atmosferico.
Metodi elettrochimici
Oggi il cloro viene prodotto su scala industriale insieme all'idrossido di sodio e all'idrogeno mediante elettrolisi di una soluzione di sale da cucina, i cui principali processi possono essere rappresentati dalla formula riassuntiva:
Applicazione
· Profilo della finestra in polimeri contenenti cloro
· Il componente principale dei decoloranti è l'acqua di Labarraco (ipoclorito di sodio)
· Nella produzione di cloruro di polivinile, composti plastici, gomma sintetica.
· Produzione di organoclorurati. Una parte significativa del cloro prodotto viene consumato per ottenere prodotti fitosanitari. Uno degli insetticidi più importanti è l'esaclorocicloesano (spesso chiamato esaclorano).
· Utilizzato come agente di guerra chimica, nonché per la produzione di altri agenti di guerra chimica: gas mostarda, fosgene.
· Per la disinfezione dell'acqua - “clorazione”.
· Registrato nell'industria alimentare come additivo alimentare E925.
· Nella produzione chimica di acido cloridrico, candeggina, sale di Berthollet, cloruri metallici, veleni, farmaci, fertilizzanti.
· Nella metallurgia per la produzione di metalli puri: titanio, stagno, tantalio, niobio.
· Come indicatore dei neutrini solari nei rivelatori di cloro-argon.
Molti paesi sviluppati stanno cercando di limitare l’uso del cloro nella vita di tutti i giorni, anche perché la combustione dei rifiuti contenenti cloro produce una quantità significativa di diossine.