إضافة الكلور. التواجد في الطبيعة
من المحتمل أن يكون الكيميائيون قد حصلوا على الكلور، لكن اكتشافه وأبحاثه الأولى يرتبطان ارتباطًا وثيقًا باسم الكيميائي السويدي الشهير كارل فيلهلم شيل. اكتشف شيلي خمسة عناصر كيميائية - الباريوم والمنغنيز (مع يوهان هان)، والموليبدينوم، والتنغستن، والكلور، وبشكل مستقل عن الكيميائيين الآخرين (وإن كان ذلك لاحقًا) - ثلاثة أخرى: الأكسجين والهيدروجين والنيتروجين. ولا يمكن لأي كيميائي أن يكرر هذا الإنجاز فيما بعد. في الوقت نفسه، كان شيلي، الذي تم انتخابه بالفعل كعضو في الأكاديمية الملكية السويدية للعلوم، صيدليًا بسيطًا في كوبينج، على الرغم من أنه كان من الممكن أن يشغل منصبًا أكثر شرفًا ومرموقة. عرض عليه فريدريك الثاني العظيم نفسه، الملك البروسي، منصب أستاذ الكيمياء في جامعة برلين. قال شيله، رافضًا مثل هذه العروض المغرية: «لا أستطيع أن آكل أكثر مما أحتاج، وما أكسبه هنا في كوبينغ يكفيني لآكل».
كانت العديد من مركبات الكلور معروفة، بالطبع، قبل فترة طويلة من شيلي. يدخل هذا العنصر في العديد من الأملاح، بما في ذلك ملح الطعام الأكثر شهرة. في عام 1774، عزل شيله الكلور في صورته الحرة عن طريق تسخين معدن البيرولوسيت الأسود مع حمض الهيدروكلوريك المركز: MnO 2 + 4HCl ® Cl 2 + MnCl 2 + 2H 2 O.
في البداية، اعتبر الكيميائيون الكلور ليس كعنصر، ولكن كمركب كيميائي لعنصر غير معروف موريا (من موريا اللاتينية - محلول ملحي) مع الأكسجين. كان يعتقد أن حمض الهيدروكلوريك (كان يسمى حمض الموريك) يحتوي على أكسجين مرتبط كيميائيا. وقد تم "الشهادة" على ذلك، على وجه الخصوص، من خلال الحقيقة التالية: عندما يقف محلول الكلور في الضوء، يتم إطلاق الأكسجين منه، ويبقى حمض الهيدروكلوريك في المحلول. ومع ذلك، فإن المحاولات العديدة "لتمزيق" الأكسجين من الكلور لم تسفر عن شيء. وبالتالي، لم يتمكن أحد من الحصول على ثاني أكسيد الكربون عن طريق تسخين الكلور بالفحم (الذي "ينزع" الأكسجين من العديد من المركبات التي تحتوي عليه عند درجات الحرارة المرتفعة). ونتيجة لتجارب مماثلة أجراها همفري ديفي وجوزيف لويس جاي لوساك ولويس جاك ثينارد، أصبح من الواضح أن الكلور لا يحتوي على الأكسجين وهو مادة بسيطة. أدت تجارب جاي لوساك، الذي قام بتحليل النسبة الكمية للغازات في تفاعل الكلور مع الهيدروجين، إلى نفس النتيجة.
في عام 1811، اقترح ديفي اسم "الكلورين" للعنصر الجديد - من اليونانية. "كلوروس" - أصفر-أخضر. هذا هو بالضبط لون الكلور. نفس الجذر موجود في كلمة "الكلوروفيل" (من الكلمة اليونانية "كلوروس" و "فيلون" - ورقة). وبعد مرور عام، قام جاي لوساك "باختصار" الاسم إلى "الكلور". ولكن لا يزال البريطانيون (والأمريكيون) يطلقون على هذا العنصر اسم "الكلور"، بينما يطلق عليه الفرنسيون اسم "الكلور". كما اعتمد الألمان، "مشرعو" الكيمياء طوال القرن التاسع عشر تقريبًا، الاسم المختصر. (في الكلور الألماني هو الكلور). في عام 1811، اقترح الفيزيائي الألماني يوهان شفايجر اسم "الهالوجين" للكلور (من الكلمة اليونانية "hals" - الملح، و "gennao" - تلد). بعد ذلك، تم تخصيص هذا المصطلح ليس فقط للكلور، ولكن أيضًا لجميع نظائره في المجموعة السابعة - الفلور والبروم واليود والأستاتين.
إن عرض احتراق الهيدروجين في جو يحتوي على الكلور أمر مثير للاهتمام: في بعض الأحيان يحدث تأثير جانبي غير عادي أثناء التجربة: يُسمع صوت طنين. في أغلب الأحيان، يطن اللهب عندما يتم إنزال أنبوب رفيع، يتم من خلاله توفير الهيدروجين، في وعاء مخروطي الشكل مملوء بالكلور؛ وينطبق الشيء نفسه على القوارير الكروية، ولكن في الاسطوانات عادة لا يطن اللهب. وكانت هذه الظاهرة تسمى "شعلة الغناء".
في المحلول المائي، يتفاعل الكلور جزئيًا وببطء مع الماء؛ عند 25 درجة مئوية، يتم تحقيق التوازن: Cl 2 + H 2 O HClO + HCl خلال يومين. يتحلل حمض الهيبوكلوروز في الضوء: HClO ® HCl + O. وهو الأكسجين الذري الذي له تأثير التبييض (الكلور الجاف تمامًا ليس لديه هذه القدرة).
يمكن أن يظهر الكلور في مركباته جميع حالات الأكسدة - من -1 إلى +7. مع الأكسجين، يشكل الكلور عددًا من الأكاسيد، جميعها في شكلها النقي غير مستقرة ومتفجرة: Cl 2 O - غاز أصفر برتقالي، ClO 2 - غاز أصفر (أقل من 9.7 درجة مئوية - سائل أحمر لامع)، بيركلورات الكلور Cl 2 O 4 (ClO –ClO 3، سائل أصفر فاتح)، Cl 2 O 6 (O 2 Cl – O – ClO 3، سائل أحمر ساطع)، Cl 2 O 7 – سائل عديم اللون، شديد الانفجار. عند درجات حرارة منخفضة، تم الحصول على أكاسيد غير مستقرة Cl 2 O 3 وClO 3. يتم إنتاج أكسيد ClO 2 على نطاق صناعي ويستخدم بدلاً من الكلور لتبييض اللب وتطهير مياه الشرب ومياه الصرف الصحي. مع الهالوجينات الأخرى، يشكل الكلور عددًا مما يسمى بمركبات الهالوجين، على سبيل المثال، ClF، ClF 3، ClF 5، BrCl، ICl، ICl 3.
الكلور ومركباته ذات حالة الأكسدة الإيجابية هي عوامل مؤكسدة قوية. وفي عام 1822، حصل الكيميائي الألماني ليوبولد جملين على الملح الأحمر من ملح الدم الأصفر عن طريق الأكسدة بالكلور: 2K 4 + Cl 2 ® K 3 + 2KCl. يعمل الكلور على أكسدة البروميدات والكلوريدات بسهولة، مما يؤدي إلى إطلاق البروم واليود في شكل حر.
يشكل الكلور في حالات الأكسدة المختلفة عددًا من الأحماض: حمض الهيدروكلوريك - هيدروكلوريك (هيدروكلوريك، أملاح - كلوريدات)، HClO - هيبوكلوروس (أملاح - هيبوكلوريت)، HClO 2 - كلور (أملاح - كلوريت)، HClO 3 - هيبوكلوروس (أملاح - كلورات). , حمض الهيدروكلوريك 4 – الكلور (الأملاح – البيركلورات). من بين أحماض الأكسجين، حمض البيركلوريك فقط هو المستقر في شكله النقي. من أملاح أحماض الأكسجين، يتم استخدام هيبوكلوريت في الممارسة العملية، كلوريت الصوديوم NaClO 2 - لتبييض الأقمشة، لتصنيع مصادر الألعاب النارية المدمجة للأكسجين ("شموع الأكسجين")، كلورات البوتاسيوم (ملح بيرتولوميتا)، الكالسيوم والمغنيسيوم (ل مكافحة الآفات الزراعية، كمكونات لتركيبات الألعاب النارية والمتفجرات، في إنتاج أعواد الثقاب)، البيركلورات - مكونات المتفجرات وتركيبات الألعاب النارية؛ بيركلورات الأمونيوم هو أحد مكونات وقود الصواريخ الصلب.
يتفاعل الكلور مع العديد من المركبات العضوية. يلتصق بسرعة بالمركبات غير المشبعة بروابط كربون-كربون مزدوجة وثلاثية (يتفاعل التفاعل مع الأسيتيلين بشكل متفجر)، ويلتصق بالبنزين في الضوء. في ظل ظروف معينة، يمكن للكلور أن يحل محل ذرات الهيدروجين في المركبات العضوية: R–H + Cl 2 ® RCl + HCl. لعب هذا التفاعل دورًا مهمًا في تاريخ الكيمياء العضوية. في أربعينيات القرن التاسع عشر، اكتشف الكيميائي الفرنسي جان بابتيست دوماس أنه عندما يتفاعل الكلور مع حمض الأسيتيك، يحدث التفاعل بسهولة مذهلة
CH 3 COOH + Cl 2 ® CH 2 ClCOOH + حمض الهيدروكلوريك. مع وجود فائض من الكلور، يتم تشكيل حمض ثلاثي كلورو أسيتيك CCl 3 COOH. ومع ذلك، كان العديد من الكيميائيين لا يثقون في عمل دوما. في الواقع، وفقًا لنظرية بيرزيليوس المقبولة عمومًا، لا يمكن استبدال ذرات الهيدروجين المشحونة إيجابيًا بذرات الكلور المشحونة سالبًا. تم تبني هذا الرأي في ذلك الوقت من قبل العديد من الكيميائيين البارزين، ومن بينهم فريدريش فولر، جوستوس ليبيج، وبالطبع بيرسيليوس نفسه.
للسخرية من دوماس، سلم فولر إلى صديقه ليبيج مقالًا نيابة عن شخص معين يدعى إس ويندلر (شويندلر - محتال باللغة الألمانية) حول التطبيق الناجح الجديد لرد الفعل الذي يُزعم أن دوما اكتشفه. في المقال، كتب فولر بسخرية واضحة عن كيف أنه في خلات المنغنيز Mn(CH 3 COO) 2 كان من الممكن استبدال جميع العناصر، حسب تكافؤها، بالكلور، مما أدى إلى مادة بلورية صفراء تتكون من الكلور فقط. وقيل أيضًا أنه في إنجلترا، من خلال استبدال جميع ذرات المركبات العضوية تباعًا بذرات الكلور، تتحول الأقمشة العادية إلى كلور، وتحتفظ الأشياء في نفس الوقت بمظهرها. جاء في الحاشية أن متاجر لندن كانت تبيع تجارة نشطة في مواد تتكون من الكلور وحده، حيث كانت هذه المادة جيدة جدًا للقبعات الليلية والسراويل الداخلية الدافئة.
يؤدي تفاعل الكلور مع المركبات العضوية إلى تكوين العديد من منتجات الكلور العضوي، ومن بينها المذيبات المستخدمة على نطاق واسع كلوريد الميثيلين CH 2 Cl 2، والكلوروفورم CHCl 3، ورابع كلوريد الكربون CCl 4، وثلاثي كلور الإيثيلين CHCl=CCl 2، ورباعي كلور الإيثيلين C 2 Cl 4. . وفي وجود الرطوبة، يؤدي الكلور إلى تلطيخ الأوراق الخضراء للنباتات والعديد من الأصباغ. تم استخدام هذا في القرن الثامن عشر. لتبييض الأقمشة.
الكلور كغاز سام.
لاحظ شيلي، الذي تلقى الكلور، رائحة قوية كريهة للغاية، وصعوبة في التنفس والسعال. وكما اكتشفنا لاحقاً، فإن الإنسان يشم رائحة الكلور حتى ولو كان لتر واحد من الهواء يحتوي على 0.005 ملغ فقط من هذا الغاز، وفي الوقت نفسه له بالفعل تأثير مهيج على الجهاز التنفسي، حيث يدمر خلايا الغشاء المخاطي للجهاز التنفسي. المسالك والرئتين. من الصعب تحمل تركيز 0.012 ملغم/لتر؛ إذا تجاوز تركيز الكلور 0.1 ملغم/لتر، يصبح الأمر مهددًا للحياة: يتسارع التنفس، ويصبح متشنجًا، ثم يصبح نادرًا بشكل متزايد، وبعد 5-25 دقيقة يتوقف التنفس. الحد الأقصى المسموح به للتركيز في هواء المؤسسات الصناعية هو 0.001 ملجم / لتر، وفي هواء المناطق السكنية - 0.00003 ملجم / لتر.
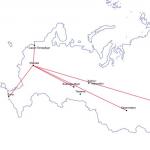
قام الأكاديمي سانت بطرسبرغ توفي إيجوروفيتش لوفيتز، بتكرار تجربة شيلي في عام 1790، بإطلاق كمية كبيرة من الكلور في الهواء عن طريق الخطأ. وبعد استنشاقه، فقد وعيه وسقط، ثم عانى من آلام شديدة في الصدر لمدة ثمانية أيام. ولحسن الحظ، تعافى. كاد الكيميائي الإنجليزي الشهير ديفي أن يموت بسبب التسمم بالكلور. تعتبر التجارب باستخدام كميات صغيرة من الكلور خطيرة، لأنها يمكن أن تسبب تلفًا شديدًا في الرئة. يقولون أن الكيميائي الألماني إيجون فيبيرج بدأ إحدى محاضراته عن الكلور بالكلمات: "الكلور غاز سام. إذا تعرضت للتسمم خلال المظاهرة القادمة، من فضلك أخرجني إلى الهواء الطلق. ولكن لسوء الحظ، يجب مقاطعة المحاضرة. إذا قمت بإطلاق الكثير من الكلور في الهواء، فسوف تصبح كارثة حقيقية. وقد شهدت ذلك القوات الأنجلو-فرنسية خلال الحرب العالمية الأولى. في صباح يوم 22 أبريل 1915، قررت القيادة الألمانية تنفيذ أول هجوم بالغاز في تاريخ الحروب: عندما هبت الرياح باتجاه العدو، على قسم صغير يبلغ طوله ستة كيلومترات من الجبهة بالقرب من مدينة إيبرس البلجيكية. وتم فتح صمامات 5730 أسطوانة في وقت واحد، تحتوي كل منها على 30 كجم من الكلور السائل. وفي غضون 5 دقائق تشكلت سحابة ضخمة ذات لون أصفر مخضر، والتي تحركت ببطء بعيدًا عن الخنادق الألمانية باتجاه الحلفاء. كان الجنود الإنجليز والفرنسيون عزلًا تمامًا. اخترق الغاز الشقوق في جميع الملاجئ، ولم يكن هناك مفر منه: بعد كل شيء، لم يتم اختراع قناع الغاز بعد. وأدى ذلك إلى تسمم 15 ألف شخص، مات منهم 5 آلاف. وبعد شهر، في 31 مايو، كرر الألمان الهجوم بالغاز على الجبهة الشرقية - ضد القوات الروسية. حدث هذا في بولندا بالقرب من مدينة بوليموفا. على الجبهة التي يبلغ طولها 12 كم، تم إطلاق 264 طنًا من خليط الكلور والفوسجين السام (كلوريد حمض الكربونيك COCl 2) من 12 ألف أسطوانة. علمت القيادة القيصرية بما حدث في إيبرس، ومع ذلك لم يكن لدى الجنود الروس أي وسيلة للدفاع! ونتيجة الهجوم بالغاز بلغت الخسائر 9146 شخصا، منهم 108 فقط نتيجة القصف بالبنادق والمدفعيات والباقون بالتسمم. وفي الوقت نفسه، توفي 1183 شخصًا على الفور تقريبًا.
وسرعان ما أظهر الكيميائيون كيفية الهروب من الكلور: تحتاج إلى التنفس من خلال ضمادة شاش مبللة بمحلول ثيوكبريتات الصوديوم (تُستخدم هذه المادة في التصوير الفوتوغرافي، وغالبًا ما يطلق عليها اسم Hyposulfite). يتفاعل الكلور بسرعة كبيرة مع محلول الثيوسلفات، مما يؤدي إلى أكسدته:
Na 2 S 2 O 3 + 4Cl 2 + 5H 2 O ® 2H 2 SO 4 + 2NaCl + 6HCl. وبطبيعة الحال، حمض الكبريتيك ليس مادة ضارة أيضا، ولكن محلوله المائي المخفف أقل خطورة بكثير من الكلور السام. لذلك، في تلك السنوات، كان للثيوكبريتات اسم آخر - "مضاد الكلور"، لكن أقنعة غاز الثيوسلفات الأولى لم تكن فعالة للغاية.
في عام 1916، اخترع الكيميائي الروسي والأكاديمي المستقبلي نيكولاي ديميترييفيتش زيلينسكي قناع غاز فعال حقًا، حيث يتم الاحتفاظ بالمواد السامة بواسطة طبقة من الكربون المنشط. مثل هذا الفحم ذو السطح المتطور للغاية يمكن أن يحتفظ بكمية من الكلور أكبر بكثير من الشاش المنقوع في الهيبسلفيت. ومن حسن الحظ أن "هجمات الكلور" ظلت مجرد حلقة مأساوية في التاريخ. بعد الحرب العالمية، لم يبق للكلور سوى المهن السلمية.
استخدام الكلور.
في كل عام، يتم إنتاج كميات هائلة من الكلور في جميع أنحاء العالم - عشرات الملايين من الأطنان. فقط في الولايات المتحدة بحلول نهاية القرن العشرين. تم إنتاج حوالي 12 مليون طن من الكلور سنويًا عن طريق التحليل الكهربائي (المركز العاشر بين الإنتاج الكيميائي). يتم إنفاق الجزء الأكبر منه (ما يصل إلى 50٪) على كلورة المركبات العضوية - لإنتاج المذيبات والمطاط الصناعي وكلوريد البوليفينيل والمواد البلاستيكية الأخرى ومطاط الكلوروبرين والمبيدات الحشرية والأدوية والعديد من المنتجات الضرورية والمفيدة الأخرى. ويتم استهلاك الباقي لتخليق الكلوريدات غير العضوية، وفي صناعة اللب والورق لتبييض لب الخشب، وتنقية المياه. يستخدم الكلور بكميات صغيرة نسبيا في صناعة المعادن. بمساعدتها يتم الحصول على معادن نقية جدًا - التيتانيوم والقصدير والتنتالوم والنيوبيوم. وبحرق الهيدروجين في الكلور يتم الحصول على كلوريد الهيدروجين، ومنه يتم الحصول على حمض الهيدروكلوريك. يستخدم الكلور أيضًا لإنتاج عوامل التبييض (هيبوكلوريت، مواد التبييض) وتطهير المياه عن طريق الكلورة.
ايليا لينسون
تعريف
الكلور- العنصر السابع عشر من الجدول الدوري . التعيين - Cl من الكلمة اللاتينية "كلوروم". يقع في الفترة الثالثة مجموعة VIIA. يشير إلى غير المعادن. الشحنة النووية 17.
وأهم مركبات الكلور الطبيعية هو كلوريد الصوديوم (ملح الطعام) NaCl. تم العثور على الكتلة الرئيسية لكلوريد الصوديوم في مياه البحار والمحيطات. تحتوي مياه العديد من البحيرات أيضًا على كميات كبيرة من كلوريد الصوديوم. كما أنه يوجد في صورة صلبة، حيث يتكون في أماكن في القشرة الأرضية طبقات سميكة مما يسمى بالملح الصخري. مركبات الكلور الأخرى شائعة أيضًا في الطبيعة، على سبيل المثال كلوريد البوتاسيوم في شكل معادن كارناليت KCl × MgCl 2 × 6H 2 O والسيلفيت KCl.
في الظروف العادية، يكون الكلور غازًا أصفر مخضرًا (الشكل 1)، وهو شديد الذوبان في الماء. عند تبريدها، يتم إطلاق الهيدرات البلورية من المحاليل المائية، وهي عبارة عن كلارات ذات تركيبة تقريبية Cl 2 × 6H 2 O وCl 2 × 8H 2 O.
أرز. 1. الكلور في الحالة السائلة. مظهر.
الكتلة الذرية والجزيئية للكلور
الكتلة الذرية النسبية لعنصر ما هي نسبة كتلة ذرة عنصر معين إلى 1/12 من كتلة ذرة الكربون. الكتلة الذرية النسبية ليس لها أبعاد ويشار إليها بالرمز A r (المؤشر "r" هو الحرف الأول من الكلمة الإنجليزية نسبي، والتي تعني "نسبي"). الكتلة الذرية النسبية للكلور الذري هي 35.457 amu.
يتم التعبير عن كتل الجزيئات، وكذلك كتل الذرات، بوحدات الكتلة الذرية. الكتلة الجزيئية للمادة هي كتلة الجزيء، معبرًا عنها بوحدات الكتلة الذرية. الكتلة الجزيئية النسبية للمادة هي نسبة كتلة جزيء مادة معينة إلى 1/12 من كتلة ذرة الكربون، كتلتها 12 amu. من المعروف أن جزيء الكلور ثنائي الذرة - Cl 2. الوزن الجزيئي النسبي لجزيء الكلور سيكون مساوياً لـ:
م ص (الكلور 2) = 35.457 × 2 ≈ 71.
نظائر الكلور
ومن المعروف أنه يمكن العثور على الكلور في الطبيعة على شكل نظيرين مستقرين هما 35 Cl (75.78%) و37 Cl (24.22%). الأعداد الكتلية لهما هي 35 و37 على التوالي. تحتوي نواة ذرة نظير الكلور 35 Cl على سبعة عشر بروتونًا وثمانية عشر نيوترونًا، ويحتوي النظير 37 Cl على نفس العدد من البروتونات وعشرين نيوترونًا.
هناك نظائر اصطناعية للكلور ذات أعداد كتلية من 35 إلى 43، وأكثرها استقرارًا هو 36 Cl مع عمر نصف يبلغ 301 ألف سنة.
أيونات الكلور
يحتوي مستوى الطاقة الخارجي لذرة الكلور على سبعة إلكترونات وهي إلكترونات التكافؤ:
1ث 2 2ث 2 2ف 6 3ث 2 3ف 5 .
نتيجة للتفاعل الكيميائي، يمكن أن يفقد الكلور إلكترونات التكافؤ الخاصة به، أي. تكون مانحة لها، وتتحول إلى أيونات موجبة الشحنة أو تقبل إلكترونات من ذرة أخرى، أي. تكون متقبلة لها وتتحول إلى أيونات سالبة الشحنة:
الكلورين 0 -7e → الكلورين 7+؛
الكلورين 0 -5e → الكلورين 5+؛
الكلورين 0 -4e → الكلورين 4+؛
الكلورين 0 -3e → الكلورين 3+؛
الكلورين 0 -2e → الكلورين 2+؛
الكلور 0 -1e → الكلور 1+ ;
Cl 0 +1e → Cl 1- .
جزيء الكلور والذرة
يتكون جزيء الكلور من ذرتين - Cl 2. فيما يلي بعض الخصائص التي تميز ذرة وجزيء الكلور:
أمثلة على حل المشكلات
مثال 1
| يمارس | ما حجم الكلور الذي يجب تناوله للتفاعل مع 10 لترات من الهيدروجين؟ الغازات تحت نفس الظروف. |
| حل | دعونا نكتب معادلة التفاعل بين الكلور والهيدروجين: Cl2 + H2 = 2HCl. دعونا نحسب كمية مادة الهيدروجين التي تفاعلت: ن (ح 2) = الخامس (ح 2) / الخامس م؛ ن (ح 2) = 10 / 22.4 = 0.45 مول. وفقا للمعادلة، n (H 2) = n (Cl 2) = 0.45 مول. فإن حجم الكلور الذي تفاعل مع الهيدروجين يساوي: |
يتم أخذ الخصائص الفيزيائية للكلور بعين الاعتبار: كثافة الكلور، موصليته الحرارية، الحرارة النوعية واللزوجة الديناميكية عند درجات حرارة مختلفة. يتم عرض الخصائص الفيزيائية للكلور 2 في شكل جداول للحالات السائلة والصلبة والغازية لهذا الهالوجين.
الخصائص الفيزيائية الأساسية للكلور
يتم تضمين الكلور في المجموعة السابعة من الفترة الثالثة من الجدول الدوري للعناصر في الرقم 17. وهو ينتمي إلى مجموعة الهالوجينات الفرعية، وله كتل ذرية وجزيئية نسبية تبلغ 35.453 و70.906 على التوالي. عند درجات حرارة أعلى من -30 درجة مئوية، يكون الكلور غازًا أصفر مخضرًا ذو رائحة قوية ومزعجة. يسيل بسهولة تحت الضغط العادي (1.013·10 5 باسكال) عند تبريده إلى -34 درجة مئوية، ويشكل سائلًا كهرمانيًا شفافًا يتصلب عند -101 درجة مئوية.
ونظرًا لنشاطه الكيميائي العالي، فإن الكلور الحر لا يتواجد في الطبيعة، ولكنه يوجد فقط على شكل مركبات. يوجد بشكل رئيسي في معدن الهاليت ()، وهو أيضًا جزء من معادن مثل السيلفيت (KCl)، الكارناليت (KCl MgCl 2 · 6H 2 O) والسيلفينيت (KCl NaCl). يقترب محتوى الكلور في القشرة الأرضية من 0.02% من إجمالي عدد ذرات القشرة الأرضية، حيث يوجد على شكل نظيرين 35 Cl و 37 Cl بنسبة مئوية 75.77% 35 Cl و 24.23% 37 Cl .
| ملكية | معنى |
|---|---|
| نقطة الانصهار، درجة مئوية | -100,5 |
| نقطة الغليان، درجة مئوية | -30,04 |
| درجة الحرارة الحرجة، درجة مئوية | 144 |
| الضغط الحرج، بنسلفانيا | 77.1 10 5 |
| الكثافة الحرجة، كجم/م3 | 573 |
| كثافة الغاز (عند 0 درجة مئوية و1.013105 باسكال)، كجم/م3 | 3,214 |
| كثافة البخار المشبع (عند 0 درجة مئوية و3.664105 باسكال)، كجم/م3 | 12,08 |
| كثافة الكلور السائل (عند 0 درجة مئوية و3.664105 باسكال)، كجم/م3 | 1468 |
| كثافة الكلور السائل (عند 15.6 درجة مئوية و6.08105 باسكال)، كجم/م3 | 1422 |
| كثافة الكلور الصلب (عند -102 درجة مئوية)، كجم/م3 | 1900 |
| الكثافة النسبية للغاز في الهواء (عند 0 درجة مئوية و1.013 · 10 5 باسكال) | 2,482 |
| الكثافة النسبية للبخار المشبع في الهواء (عند 0 درجة مئوية و3.664 · 10 5 باسكال) | 9,337 |
| الكثافة النسبية للكلور السائل عند 0 درجة مئوية (بالنسبة للماء عند 4 درجات مئوية) | 1,468 |
| الحجم النوعي للغاز (عند 0 درجة مئوية و1.013 · 10 5 باسكال)، م 3 / كجم | 0,3116 |
| الحجم النوعي للبخار المشبع (عند 0 درجة مئوية و3.664 10 5 باسكال)، م 3 / كغ | 0,0828 |
| الحجم النوعي للكلور السائل (عند 0 درجة مئوية و3.664 10 5 باسكال)، م 3 / كجم | 0,00068 |
| ضغط بخار الكلور عند 0 درجة مئوية، Pa | 3.664 10 5 |
| اللزوجة الديناميكية للغاز عند 20 درجة مئوية، 10 -3 باسكال | 0,013 |
| اللزوجة الديناميكية للكلور السائل عند 20 درجة مئوية، 10 -3 باسكال | 0,345 |
| حرارة انصهار الكلور الصلب (عند نقطة الانصهار)، كيلوجول/كجم | 90,3 |
| حرارة التبخر (عند نقطة الغليان)، كيلوجول/كجم | 288 |
| حرارة التسامي (عند نقطة الانصهار)، كيلوجول/مول | 29,16 |
| السعة الحرارية المولية C p للغاز (عند -73...5727 درجة مئوية)، J/(mol K) | 31,7…40,6 |
| السعة الحرارية المولية C p للكلور السائل (عند -101...-34 درجة مئوية)، J/(mol K) | 67,1…65,7 |
| معامل التوصيل الحراري للغاز عند 0 درجة مئوية، W/(mK) | 0,008 |
| معامل التوصيل الحراري للكلور السائل عند 30 درجة مئوية، W/(mK) | 0,62 |
| المحتوى الحراري للغاز، كيلوجول/كجم | 1,377 |
| المحتوى الحراري للبخار المشبع، كيلوجول/كجم | 1,306 |
| المحتوى الحراري للكلور السائل، كيلوجول/كجم | 0,879 |
| معامل الانكسار عند 14 درجة مئوية | 1,367 |
| الموصلية الكهربائية المحددة عند -70 درجة مئوية، S/m | 10 -18 |
| تقارب الإلكترون، كيلوجول / مول | 357 |
| طاقة التأين، كيلوجول/مول | 1260 |
كثافة الكلور
في الظروف العادية، يكون الكلور غازًا ثقيلًا تبلغ كثافته حوالي 2.5 مرة. كثافة الكلور الغازي والسائل في الظروف العادية (عند 0 درجة مئوية) تساوي 3.214 و1468 كجم/م3 على التوالي. عند تسخين الكلور السائل أو الغازي، تنخفض كثافته بسبب زيادة حجمه بسبب التمدد الحراري.
كثافة غاز الكلور
يوضح الجدول كثافة الكلور في الحالة الغازية عند درجات حرارة مختلفة (تتراوح من -30 إلى 140 درجة مئوية) والضغط الجوي العادي (1.013·10 5 باسكال). تتغير كثافة الكلور مع درجة الحرارة - فهي تقل عند تسخينها. على سبيل المثال، عند 20 درجة مئوية تكون كثافة الكلور 2.985 كجم/م3وعندما ترتفع درجة حرارة هذا الغاز إلى 100 درجة مئوية تنخفض قيمة كثافته إلى قيمة 2.328 كجم/م3.
| ر، درجة مئوية | ρ، كجم/م 3 | ر، درجة مئوية | ρ، كجم/م 3 |
|---|---|---|---|
| -30 | 3,722 | 60 | 2,616 |
| -20 | 3,502 | 70 | 2,538 |
| -10 | 3,347 | 80 | 2,464 |
| 0 | 3,214 | 90 | 2,394 |
| 10 | 3,095 | 100 | 2,328 |
| 20 | 2,985 | 110 | 2,266 |
| 30 | 2,884 | 120 | 2,207 |
| 40 | 2,789 | 130 | 2,15 |
| 50 | 2,7 | 140 | 2,097 |
ومع زيادة الضغط، تزداد كثافة الكلور. توضح الجداول أدناه كثافة غاز الكلور في نطاق درجة الحرارة من -40 إلى 140 درجة مئوية والضغط من 26.6·10 5 إلى 213·10 5 باسكال. مع زيادة الضغط، تزداد كثافة الكلور في الحالة الغازية بشكل متناسب. على سبيل المثال، زيادة ضغط الكلور من 53.2·10 5 إلى 106.4·10 5 باسكال عند درجة حرارة 10 درجة مئوية تؤدي إلى زيادة مضاعفة في كثافة هذا الغاز.
| ↓ ر، درجة مئوية | ف، كبا → | 26,6 | 53,2 | 79,8 | 101,3 |
|---|---|---|---|---|
| -40 | 0,9819 | 1,996 | — | — |
| -30 | 0,9402 | 1,896 | 2,885 | 3,722 |
| -20 | 0,9024 | 1,815 | 2,743 | 3,502 |
| -10 | 0,8678 | 1,743 | 2,629 | 3,347 |
| 0 | 0,8358 | 1,678 | 2,528 | 3,214 |
| 10 | 0,8061 | 1,618 | 2,435 | 3,095 |
| 20 | 0,7783 | 1,563 | 2,35 | 2,985 |
| 30 | 0,7524 | 1,509 | 2,271 | 2,884 |
| 40 | 0,7282 | 1,46 | 2,197 | 2,789 |
| 50 | 0,7055 | 1,415 | 2,127 | 2,7 |
| 60 | 0,6842 | 1,371 | 2,062 | 2,616 |
| 70 | 0,6641 | 1,331 | 2 | 2,538 |
| 80 | 0,6451 | 1,292 | 1,942 | 2,464 |
| 90 | 0,6272 | 1,256 | 1,888 | 2,394 |
| 100 | 0,6103 | 1,222 | 1,836 | 2,328 |
| 110 | 0,5943 | 1,19 | 1,787 | 2,266 |
| 120 | 0,579 | 1,159 | 1,741 | 2,207 |
| 130 | 0,5646 | 1,13 | 1,697 | 2,15 |
| 140 | 0,5508 | 1,102 | 1,655 | 2,097 |
| ↓ ر، درجة مئوية | ف، كبا → | 133 | 160 | 186 | 213 |
|---|---|---|---|---|
| -20 | 4,695 | 5,768 | — | — |
| -10 | 4,446 | 5,389 | 6,366 | 7,389 |
| 0 | 4,255 | 5,138 | 6,036 | 6,954 |
| 10 | 4,092 | 4,933 | 5,783 | 6,645 |
| 20 | 3,945 | 4,751 | 5,565 | 6,385 |
| 30 | 3,809 | 4,585 | 5,367 | 6,154 |
| 40 | 3,682 | 4,431 | 5,184 | 5,942 |
| 50 | 3,563 | 4,287 | 5,014 | 5,745 |
| 60 | 3,452 | 4,151 | 4,855 | 5,561 |
| 70 | 3,347 | 4,025 | 4,705 | 5,388 |
| 80 | 3,248 | 3,905 | 4,564 | 5,225 |
| 90 | 3,156 | 3,793 | 4,432 | 5,073 |
| 100 | 3,068 | 3,687 | 4,307 | 4,929 |
| 110 | 2,985 | 3,587 | 4,189 | 4,793 |
| 120 | 2,907 | 3,492 | 4,078 | 4,665 |
| 130 | 2,832 | 3,397 | 3,972 | 4,543 |
| 140 | 2,761 | 3,319 | 3,87 | 4,426 |
كثافة الكلور السائل
يمكن أن يتواجد الكلور السائل في نطاق درجة حرارة ضيق نسبيًا، تتراوح حدوده من -100.5 إلى زائد 144 درجة مئوية (أي من نقطة الانصهار إلى درجة الحرارة الحرجة). ففوق درجة حرارة 144 درجة مئوية، لن يتحول الكلور إلى الحالة السائلة تحت أي ضغط. وتتراوح كثافة الكلور السائل في نطاق درجات الحرارة هذا من 1717 إلى 573 كجم/م3.
| ر، درجة مئوية | ρ، كجم/م 3 | ر، درجة مئوية | ρ، كجم/م 3 |
|---|---|---|---|
| -100 | 1717 | 30 | 1377 |
| -90 | 1694 | 40 | 1344 |
| -80 | 1673 | 50 | 1310 |
| -70 | 1646 | 60 | 1275 |
| -60 | 1622 | 70 | 1240 |
| -50 | 1598 | 80 | 1199 |
| -40 | 1574 | 90 | 1156 |
| -30 | 1550 | 100 | 1109 |
| -20 | 1524 | 110 | 1059 |
| -10 | 1496 | 120 | 998 |
| 0 | 1468 | 130 | 920 |
| 10 | 1438 | 140 | 750 |
| 20 | 1408 | 144 | 573 |
السعة الحرارية النوعية للكلور
يمكن حساب السعة الحرارية النوعية لغاز الكلور C p بـ kJ/(kg K) في نطاق درجات الحرارة من 0 إلى 1200 درجة مئوية والضغط الجوي العادي باستخدام الصيغة:
حيث T هي درجة الحرارة المطلقة للكلور بالدرجات كلفن.
تجدر الإشارة إلى أنه في الظروف العادية تكون السعة الحرارية النوعية للكلور 471 جول/(كجم ك) وتزداد عند تسخينه. تصبح الزيادة في السعة الحرارية عند درجات حرارة أعلى من 500 درجة مئوية ضئيلة، وفي درجات الحرارة المرتفعة تظل الحرارة النوعية للكلور دون تغيير تقريبًا.
يوضح الجدول نتائج حساب الحرارة النوعية للكلور باستخدام الصيغة أعلاه (خطأ الحساب حوالي 1٪).
| ر، درجة مئوية | ج ص، J/(كجم ك) | ر، درجة مئوية | ج ص، J/(كجم ك) |
|---|---|---|---|
| 0 | 471 | 250 | 506 |
| 10 | 474 | 300 | 508 |
| 20 | 477 | 350 | 510 |
| 30 | 480 | 400 | 511 |
| 40 | 482 | 450 | 512 |
| 50 | 485 | 500 | 513 |
| 60 | 487 | 550 | 514 |
| 70 | 488 | 600 | 514 |
| 80 | 490 | 650 | 515 |
| 90 | 492 | 700 | 515 |
| 100 | 493 | 750 | 515 |
| 110 | 494 | 800 | 516 |
| 120 | 496 | 850 | 516 |
| 130 | 497 | 900 | 516 |
| 140 | 498 | 950 | 516 |
| 150 | 499 | 1000 | 517 |
| 200 | 503 | 1100 | 517 |
عند درجات حرارة قريبة من الصفر المطلق، يكون الكلور في حالة صلبة وله قدرة حرارية نوعية منخفضة (19 جول/(كجم كلفن)). مع زيادة درجة حرارة Cl 2 الصلب، تزيد سعته الحرارية وتصل إلى قيمة 720 J/(kg K) عند درجة حرارة -143 درجة مئوية.
يمتلك الكلور السائل سعة حرارية محددة تبلغ 918...949 جول/(كجم كلفن) في المدى من 0 إلى -90 درجة مئوية. من خلال الجدول يمكن ملاحظة أن السعة الحرارية النوعية للكلور السائل أعلى من الكلور الغازي وتتناقص مع زيادة درجة الحرارة.
الموصلية الحرارية للكلور
ويبين الجدول قيم معاملات التوصيل الحراري لغاز الكلور عند الضغط الجوي الطبيعي في مدى درجات الحرارة من -70 إلى 400 درجة مئوية.
معامل التوصيل الحراري للكلور في الظروف العادية هو 0.0079 واط/(م درجة)، وهو أقل بثلاث مرات من نفس درجة الحرارة والضغط. يؤدي تسخين الكلور إلى زيادة التوصيل الحراري. وهكذا، عند درجة حرارة 100 درجة مئوية، تزيد قيمة هذه الخاصية الفيزيائية للكلور إلى 0.0114 واط/(م درجة).
| ر، درجة مئوية | LA، ث/(م درجة) | ر، درجة مئوية | LA، ث/(م درجة) |
|---|---|---|---|
| -70 | 0,0054 | 50 | 0,0096 |
| -60 | 0,0058 | 60 | 0,01 |
| -50 | 0,0062 | 70 | 0,0104 |
| -40 | 0,0065 | 80 | 0,0107 |
| -30 | 0,0068 | 90 | 0,0111 |
| -20 | 0,0072 | 100 | 0,0114 |
| -10 | 0,0076 | 150 | 0,0133 |
| 0 | 0,0079 | 200 | 0,0149 |
| 10 | 0,0082 | 250 | 0,0165 |
| 20 | 0,0086 | 300 | 0,018 |
| 30 | 0,009 | 350 | 0,0195 |
| 40 | 0,0093 | 400 | 0,0207 |
لزوجة الكلور
يمكن حساب معامل اللزوجة الديناميكية للكلور الغازي في نطاق درجة الحرارة 20...500 درجة مئوية تقريبًا باستخدام الصيغة:
حيث η T هو معامل اللزوجة الديناميكية للكلور عند درجة حرارة معينة T، K؛
η T 0 - معامل اللزوجة الديناميكية للكلور عند درجة الحرارة T 0 = 273 K (في الظروف العادية)؛
C هو ثابت ساذرلاند (للكلور C = 351).
في ظل الظروف العادية، تبلغ اللزوجة الديناميكية للكلور 0.0123·10 -3 Pa·s. عند تسخينه، تأخذ الخاصية الفيزيائية للكلور، مثل اللزوجة، قيمًا أعلى.
يحتوي الكلور السائل على لزوجة أعلى من الكلور الغازي. على سبيل المثال، عند درجة حرارة 20 درجة مئوية، تبلغ قيمة اللزوجة الديناميكية للكلور السائل 0.345·10 -3 باسكال وتتناقص مع زيادة درجة الحرارة.
مصادر:
- Barkov S. A. الهالوجينات ومجموعة المنغنيز الفرعية. عناصر المجموعة السابعة من الجدول الدوري لـ D. I. Mendeleev. دليل للطلاب. م: التربية، 1976 - 112 ص.
- جداول الكميات الفيزيائية. الدليل. إد. أكاد. آي كيه كيكوينا. م: اتميزدات، 1976 - 1008 ص.
- Yakimenko L. M.، Pasmanik M. I. كتيب عن إنتاج الكلور والصودا الكاوية ومنتجات الكلور الأساسية. إد. الثاني لكل. وآخرون م: الكيمياء، 1976 - 440 ص.
تم الحصول على الكلور لأول مرة في عام 1772 من قبل شيلي، الذي وصف إطلاقه أثناء تفاعل البيرولوزيت مع حمض الهيدروكلوريك في أطروحته عن البيرولوزيت: 4HCl + MnO 2 = Cl 2 + MnCl 2 + 2H 2 O
وأشار شيلي إلى رائحة الكلور، المشابهة لرائحة الماء الملكي، وقدرته على التفاعل مع الذهب والزنجفر، وخصائصه المبيضة. ومع ذلك، اقترح شيله، وفقًا لنظرية الفلوجستون التي كانت سائدة في الكيمياء في ذلك الوقت، أن الكلور عبارة عن حمض الهيدروكلوريك المزيل للفلوجيستون، أي أكسيد حمض الهيدروكلوريك.
اقترح برتولت ولافوازييه أن الكلور هو أكسيد لعنصر الموريا، لكن محاولات عزله ظلت غير ناجحة حتى عمل ديفي، الذي تمكن من تحليل ملح الطعام إلى صوديوم وكلور عن طريق التحليل الكهربائي.
اسم العنصر يأتي من اليونانية clwroz- "أخضر".
يجري في الطبيعة، وتلقي:
الكلور الطبيعي عبارة عن خليط من نظيرين 35 Cl و 37 Cl. في القشرة الأرضية، الكلور هو الهالوجين الأكثر شيوعًا. بما أن الكلور نشط للغاية، فإنه يحدث في الطبيعة فقط في شكل مركبات في المعادن: هاليت كلوريد الصوديوم، سيلفيت بوكل، سيلفينيت بوكل كلوريد الصوديوم، بيشوفيت MgCl 2 · 6H 2 O، كارناليت KCl MgCl 2 · 6H 2 O، كينيت KCl MgSO 4 · 3H 2 O. أكبر احتياطيات الكلور موجودة في أملاح مياه البحار والمحيطات.
على المستوى الصناعي، يتم إنتاج الكلور مع هيدروكسيد الصوديوم والهيدروجين من خلال التحليل الكهربائي لمحلول ملح الطعام:
2NaCl + 2H2O => H2 + Cl2 + 2NaOH
لاستعادة الكلور من كلوريد الهيدروجين، وهو منتج ثانوي أثناء الكلورة الصناعية للمركبات العضوية، يتم استخدام عملية الشماس (الأكسدة الحفزية لكلوريد الهيدروجين مع الأكسجين الجوي):
4HCl + O2 = 2H2O + 2Cl2
تعتمد العمليات المستخدمة عادةً في المختبرات على أكسدة كلوريد الهيدروجين بعوامل مؤكسدة قوية (على سبيل المثال، أكسيد المنغنيز (IV)، وبرمنجنات البوتاسيوم، وثنائي كرومات البوتاسيوم):
2KMnO4 + 16HCl = 5Cl2 + 2MnCl2 + 2KCl +8H2O
K2Cr2O7 + 14HCl = 3Cl2 + 2CrCl3 + 2KCl + 7H2O
الخصائص الفيزيائية:
في الظروف العادية، يكون الكلور غازًا أصفر مخضرًا ذو رائحة خانقة. الكلور قابل للذوبان بشكل ملحوظ في الماء ("ماء الكلور"). عند درجة حرارة 20 درجة مئوية، يذوب 2.3 حجم من الكلور في حجم واحد من الماء. نقطة الغليان = -34 درجة مئوية؛ نقطة الانصهار = -101 درجة مئوية، الكثافة (الغاز، غير محددة) = 3.214 جم/لتر.
الخواص الكيميائية:
الكلور نشط للغاية - فهو يتحد بشكل مباشر مع جميع عناصر الجدول الدوري تقريبًا، بما في ذلك المعادن وغير المعادن (باستثناء الكربون والنيتروجين والأكسجين والغازات الخاملة). الكلور هو عامل مؤكسد قوي للغاية، حيث يحل محل اللافلزات الأقل نشاطًا (البروم واليود) من مركباتها بالهيدروجين والمعادن:
Cl2 + 2HBr = Br2 + 2HCl؛ الكلورين 2 + 2NaI = أنا 2 + 2NaCl
عند ذوبانه في الماء أو القلويات، يتفكك الكلور مكونًا حمض الهيبوكلوروس (وعند تسخينه، البيركلوريك) وأحماض الهيدروكلوريك أو أملاحها.
Cl 2 + H 2 O HClO + HCl؛
يتفاعل الكلور مع العديد من المركبات العضوية ويدخل في تفاعلات الاستبدال أو الإضافة:
CH 3 -CH 3 + xCl 2 => C 2 H 6-x Cl x + xHCl
CH 2 = CH 2 + Cl 2 => Cl-CH 2 -CH 2 -Cl
C 6 H 6 + Cl 2 => C 6 H 6 Cl + حمض الهيدروكلوريك
يحتوي الكلور على سبع حالات أكسدة: -1، 0، +1، +3، +4، +5، +7.
أهم الإتصالات:
كلوريد الهيدروجين HCl- غاز عديم اللون يدخن في الهواء بسبب تكون قطرات الضباب مع بخار الماء. له رائحة نفاذة ويهيج الجهاز التنفسي بشدة. موجود في الغازات البركانية والمياه وفي عصير المعدة. تعتمد الخواص الكيميائية على الحالة التي هي عليها (يمكن أن تكون في حالة غازية أو سائلة أو محلولية). يسمى محلول HCl حامض الهيدروكلوريك. وهو حمض قوي ويزيح الأحماض الأضعف من أملاحها. الأملاح - كلوريدات- مواد بلورية صلبة ذات نقاط انصهار عالية.
الكلوريدات التساهمية- مركبات الكلور مع غير المعادن أو الغازات أو السوائل أو المواد الصلبة القابلة للانصهار التي لها خصائص حمضية مميزة، وعادة ما يتم تحللها بالماء بسهولة لتكوين حمض الهيدروكلوريك:
PCl 5 + 4H 2 O = H 3 PO 4 + 5HCl؛
أكسيد الكلور (I) Cl2O.- غاز ذو لون أصفر مائل للبني وله رائحة نفاذة. يؤثر على أعضاء الجهاز التنفسي. يذوب بسهولة في الماء ويشكل حمض الهيبوكلوروس.
حمض هيبوكلوروس HClO. موجود فقط في الحلول. وهو حمض ضعيف وغير مستقر. يتحلل بسهولة إلى حمض الهيدروكلوريك والأكسجين. عامل مؤكسد قوي. يتكون عندما يذوب الكلور في الماء. الأملاح - هيبوكلوريت، استقرار منخفض (NaClO*H 2 O يتحلل بشكل متفجر عند 70 درجة مئوية)، عوامل مؤكسدة قوية. تستخدم على نطاق واسع للتبييض والتطهير مسحوق التبييض، ملح مخلوط Ca(Cl)OCl
حمض الكلوروس HClO2، في شكله الحر غير مستقر، حتى في محلول مائي مخفف يتحلل بسرعة. حمض وأملاح متوسطة القوة - الكلوريتكقاعدة عامة، تكون عديمة اللون وقابلة للذوبان بدرجة عالية في الماء. على عكس هيبوكلوريت، يظهر الكلوريت خصائص مؤكسدة واضحة فقط في البيئة الحمضية. الاستخدام الأكبر (لتبييض الأقمشة وعجائن الورق) هو كلوريت الصوديوم NaClO 2.
أكسيد الكلور (IV) ClO2، هو غاز أصفر مخضر، له رائحة كريهة (نفاذة)، ...
حمض الكلوريك، HClO 3 - في شكله الحر غير مستقر: فهو غير متناسب مع ClO 2 وHClO 4. الأملاح - كلورات; وأهمها كلورات الصوديوم والبوتاسيوم والكالسيوم والمغنيسيوم. هذه عوامل مؤكسدة قوية وتكون قابلة للانفجار عند مزجها مع عوامل اختزال. كلورات البوتاسيوم ( ملح بيرثوليت) - تم استخدام KClO 3 لإنتاج الأكسجين في المختبر، ولكن لشدة خطورته لم يعد يستخدم. واستخدمت محاليل كلورات البوتاسيوم كمطهر ضعيف وغرغرة طبية خارجية.
حمض البيركلوريك HClO4، في المحاليل المائية، يعد حمض البيركلوريك هو الأكثر ثباتًا بين جميع أحماض الكلور المحتوية على الأكسجين. حمض البيركلوريك اللامائي، الذي يتم الحصول عليه باستخدام حمض الكبريتيك المركز من 72٪ HClO 4، ليس مستقرًا جدًا. وهو أقوى حمض أحادي البروتيك (في محلول مائي). الأملاح - البيركلورات، تستخدم كمؤكسدات (محركات الصواريخ التي تعمل بالوقود الصلب).
طلب:
يستخدم الكلور في العديد من الصناعات والعلوم والاحتياجات المنزلية:
- في إنتاج كلوريد البوليفينيل والمركبات البلاستيكية والمطاط الصناعي.
- لتبييض الأقمشة والورق.
- إنتاج المبيدات الحشرية الكلورية العضوية - وهي مواد تقتل الحشرات الضارة بالمحاصيل ولكنها آمنة للنباتات؛
- لتطهير المياه - "الكلورة"؛
- مسجل في صناعة المواد الغذائية كمضاف غذائي E925؛
- في الإنتاج الكيميائي لحمض الهيدروكلوريك، والمبيضات، وملح البرثوليت، وكلوريدات المعادن، والسموم، والأدوية، والأسمدة؛
- في علم المعادن لإنتاج المعادن النقية: التيتانيوم، القصدير، التنتالوم، النيوبيوم.
الدور البيولوجي والسمية:
يعد الكلور أحد أهم العناصر الحيوية وهو جزء من جميع الكائنات الحية. في الحيوانات والبشر، تشارك أيونات الكلور في الحفاظ على التوازن الأسموزي، ويتمتع أيون الكلوريد بنصف قطر مثالي للاختراق عبر غشاء الخلية. تعتبر أيونات الكلور حيوية للنباتات، حيث تشارك في استقلاب الطاقة في النباتات، وتنشيط الفسفرة التأكسدية.
الكلور على شكل مادة بسيطة سام، فإذا دخل إلى الرئتين يسبب حروقاً في أنسجة الرئة واختناقاً. وله تأثير مهيج للجهاز التنفسي بتركيز في الهواء يبلغ حوالي 0.006 ملغم/لتر (أي ضعف عتبة إدراك رائحة الكلور). كان الكلور أحد العناصر الكيميائية الأولى التي استخدمتها ألمانيا في الحرب العالمية الأولى.
كوروتكوفا يو، شفيتسوفا آي.
جامعة ولاية HF تيومين، 571 مجموعة.
المصادر: ويكيبيديا: http://ru.wikipedia.org/wiki/Cl، وما إلى ذلك،
موقع الجامعة التقنية الكيميائية الروسية الذي يحمل اسمه. دي آي مندليف:
خصائص عناصر المجموعة السابعة من المجموعة الفرعية الرئيسية مع استخدام الكلور كمثال
الخصائص العامة للمجموعة الفرعية
الجدول 1. تسميات عناصر المجموعة الفرعية VIIA
العناصر P، النموذجية، اللافلزية (الأستاتين شبه معدن)، الهالوجينات.
المخطط الإلكتروني للعنصر Hal (Hal ≠ F):
تتميز عناصر المجموعة الفرعية VIIA بالتكافؤ التالي:
الجدول 2. التكافؤ
3. تتميز عناصر المجموعة الفرعية VIIA بحالات الأكسدة التالية:
الجدول 3. حالات الأكسدة للعناصر
خصائص العنصر الكيميائي
الكلور هو أحد عناصر المجموعة السابعة أ. الرقم التسلسلي 17
الكتلة الذرية النسبية: 35.4527 أ. إم (جم/مول)
 عدد البروتونات والنيوترونات والإلكترونات: 17،18،17
عدد البروتونات والنيوترونات والإلكترونات: 17،18،17
التركيب الذري:
![]()
الصيغة الإلكترونية:
حالات الأكسدة النموذجية: -1، 0، +1، +3، +4، +5، +7
طاقة التأين: 1254.9(13.01) كيلوجول/مول (إي فولت)
تقارب الإلكترون: 349 (كيلو جول/مول)
السالبية الكهربية حسب بولينج: 3.20
خصائص المادة البسيطة
نوع الرابطة: تساهمية غير قطبية
جزيء ثنائي الذرة
النظائر: 35 Cl (75.78%) و37 Cl (24.22%)
نوع الشبكة البلورية: جزيئي
المعلمات الديناميكية الحرارية
الجدول 4
الخصائص الفيزيائية
الجدول 5
الخواص الكيميائية
محلول مائي من الكلور متفكك بدرجة عالية ("ماء الكلور")
المرحلة 1: Cl 2 + H 2 O = HCl + HOCl
المرحلة 2: HOCl = HCl + [O] – الأكسجين الذري
تتناقص قدرة الأكسدة في المجموعة الفرعية من الفلور إلى اليود = ˃
الكلور عامل مؤكسد قوي:
1. التفاعل مع المواد البسيطة
أ) مع الهيدروجين:
Cl2 + H2 = 2HCl
ب) مع المعادن:
Cl2 + 2Na = 2NaCl
3Cl2 + 2Fe = 2FeCl3
ج) مع بعض اللافلزات الأقل سالبية كهربية:
3Cl2 + 2P = 2PCl3
Cl 2 + S = SCl 2
مع الأكسجين والكربون والنيتروجين والكلور مباشرة لا يتفاعل!
2. التفاعل مع المواد المعقدة
أ) بالماء: انظر أعلاه
ب) مع الأحماض: لا يتفاعل!
ج) مع المحاليل القلوية:
في البرد: Cl 2 +2 NaOH = NaCl + NaClO + H 2 O
عند التسخين: 3Cl 2 + 6 KOH = 5KCl + KClO 3 + 3H 2 O
ه) مع العديد من المواد العضوية:
Cl 2 + CH 4 = CH 3 Cl + حمض الهيدروكلوريك
C 6 H 6 + Cl 2 = C 6 H 5 Cl + حمض الهيدروكلوريك
أهم مركبات الكلور
 كلوريد الهيدروجين، كلوريد الهيدروجين(حمض الهيدروكلوريك) هو غاز عديم اللون ومستقر حرارياً (في الظروف العادية) وله رائحة نفاذة، وأبخرة في الهواء الرطب، ويذوب بسهولة في الماء (ما يصل إلى 500 مجلد من الغاز لكل حجم من الماء) لتكوين حمض الهيدروكلوريك (الهيدروكلوريك). عند -114.22 درجة مئوية، يتحول حمض الهيدروكلوريك إلى حالة صلبة. في الحالة الصلبة، يوجد كلوريد الهيدروجين في شكل تعديلين بلوريين: معيني معيني، ومستقر في الأسفل، ومكعب.
كلوريد الهيدروجين، كلوريد الهيدروجين(حمض الهيدروكلوريك) هو غاز عديم اللون ومستقر حرارياً (في الظروف العادية) وله رائحة نفاذة، وأبخرة في الهواء الرطب، ويذوب بسهولة في الماء (ما يصل إلى 500 مجلد من الغاز لكل حجم من الماء) لتكوين حمض الهيدروكلوريك (الهيدروكلوريك). عند -114.22 درجة مئوية، يتحول حمض الهيدروكلوريك إلى حالة صلبة. في الحالة الصلبة، يوجد كلوريد الهيدروجين في شكل تعديلين بلوريين: معيني معيني، ومستقر في الأسفل، ومكعب.
يسمى المحلول المائي لكلوريد الهيدروجين بحمض الهيدروكلوريك. عند إذابته في الماء تحدث العمليات التالية:
حمض الهيدروكلوريك g + H 2 O l = H 3 O + l + Cl − l
عملية الذوبان طاردة للحرارة للغاية. مع الماء، يشكل حمض الهيدروكلوريك خليطًا أزيوتروبيًا. وهو حمض أحادي البروتيك قوي. يتفاعل بقوة مع جميع المعادن في سلسلة الجهد على يسار الهيدروجين، مع الأكاسيد الأساسية والمذبذبة والقواعد والأملاح، مكونًا الأملاح - كلوريدات:
ملغم + 2 حمض الهيدروكلوريك → مجكل 2 + ح 2
FeO + 2 حمض الهيدروكلوريك → FeCl 2 + H 2 O
عند تعرضه لعوامل مؤكسدة قوية أو أثناء التحليل الكهربائي، يظهر كلوريد الهيدروجين خصائص مختزلة:
MnO 2 + 4 HCl → MnCl 2 + Cl 2 + 2 H 2 O
عند تسخينه، يتأكسد كلوريد الهيدروجين بواسطة الأكسجين (المحفز - كلوريد النحاس الثنائي CuCl 2):
4 حمض الهيدروكلوريك + O2 → 2 H2O +2 Cl 2
ومع ذلك، يتفاعل حمض الهيدروكلوريك المركز مع النحاس ليشكل مركب نحاس أحادي التكافؤ:
2 نحاس + 4 حمض الهيدروكلوريك → 2 ح + ح 2
يُطلق على خليط مكون من 3 أجزاء من حيث الحجم من حمض الهيدروكلوريك المركز وجزء واحد من حيث الحجم من حمض النيتريك المركز اسم "أكوا ريجيا". يمكن للأكوا ريجيا أن تذيب الذهب والبلاتين. يرجع النشاط التأكسدي العالي للأكوا ريجيا إلى وجود كلوريد النتروسيل والكلور فيه، وهما في حالة توازن مع المواد الأولية:
4 H 3 O + + 3 Cl − + NO 3 − = NOCl + Cl 2 + 6 H 2 O
بسبب التركيز العالي لأيونات الكلوريد في المحلول، يرتبط المعدن بمركب كلوريد، مما يعزز ذوبانه:
3 بت + 4 HNO 3 + 18 حمض الهيدروكلوريك → 3 H 2 + 4 NO + 8 H 2 O
يتميز كلوريد الهيدروجين أيضًا بتفاعلات الإضافة إلى روابط متعددة (الإضافة الكهربية):
R-CH = CH 2 + حمض الهيدروكلوريك → R-CH Cl-CH 3
R-C≡CH + 2 حمض الهيدروكلوريك → R-CCl 2 -CH 3
أكاسيد الكلور- مركبات كيميائية غير عضوية من الكلور والأكسجين، صيغتها العامة: Cl x O y.
يشكل الكلور الأكاسيد التالية: Cl 2 O، Cl 2 O 3، ClO 2، Cl 2 O 4، Cl 2 O 6، Cl 2 O 7. وبالإضافة إلى ذلك، فإن ما يلي معروف: جذر ClO قصير العمر، وجذر بيروكسيد الكلور ClOO، وجذر رباعي أكسيد الكلور ClO 4 .
ويبين الجدول أدناه خصائص أكاسيد الكلور المستقرة:
الجدول 6
| ملكية | Cl2O | ClO2 | كلو كلو 3 | Cl 2 O 6 (ل) ↔2ClO 3 (جم) | Cl2O7 |
| اللون والحالة في الغرفة. درجة حرارة | الغاز الأصفر والبني | الغاز الأصفر والأخضر | سائل أصفر فاتح | سائل أحمر داكن | سائل عديم اللون |
| حالة أكسدة الكلور | (+1) | (+4) | (+1), (+7) | (+6) | (+7) |
| T. رر، درجة مئوية | −120,6 | −59 | −117 | 3,5 | −91,5 |
| درجة حرارة الغليان، درجة مئوية | 2,0 | 44,5 | |||
| د(و، 0 درجة مئوية)، جم * سم -3 | - | 1,64 | 1,806 | - | 2,02 |
| عينة ΔH° (غاز، 298 كلفن)، kJ*mol -1 | 80,3 | 102,6 | ~180 | (155) | |
| عينة ΔG° (غاز، 298 كلفن)، kJ*mol -1 | 97,9 | 120,6 | - | - | - |
| عينة S° (غاز، 298 كلفن)، J*K -1 *mol -1 | 265,9 | 256,7 | 327,2 | - | - |
| عزم ثنائي القطب μ، D | 0.78 ± 0.08 | 1.78 ± 0.01 | - | - | 0.72 ± 0.02 |
 أكسيد الكلور (I)،أكسيد ثنائي الكلور، أنهيدريد حمض هيبوكلوروس - مركب الكلور في حالة الأكسدة +1 مع الأكسجين.
أكسيد الكلور (I)،أكسيد ثنائي الكلور، أنهيدريد حمض هيبوكلوروس - مركب الكلور في حالة الأكسدة +1 مع الأكسجين.
في الظروف العادية، يكون غازًا أصفر مائلًا إلى البني وله رائحة مميزة تذكرنا بالكلور. عند درجات حرارة أقل من 2 درجة مئوية، يكون لون السائل أحمر ذهبي. سام: يؤثر على الجهاز التنفسي. يتحلل تلقائياً ببطء:
متفجرة بتركيزات عالية. تبلغ الكثافة في الظروف العادية 3.22 كجم/م3. يذوب في رابع كلوريد الكربون. يذوب في الماء لتكوين حمض هيبوكلوروس ضعيف:
يتفاعل بسرعة مع القلويات:
Cl2O + 2NaOH (dil.) = 2NaClO + H2O
ثاني أكسيد الكلور- أكسيد الحمض. عندما يذوب في الماء، يتم تشكيل أحماض الكلوروس والبيركلوريك (تفاعل عدم التناسب). تكون المحاليل المخففة مستقرة في الظلام وتتحلل ببطء في الضوء:
 ثاني أكسيد الكلور- أكسيد الكلور ( رابعا)، مركب من الكلور والأكسجين، الصيغة: ClO 2.
ثاني أكسيد الكلور- أكسيد الكلور ( رابعا)، مركب من الكلور والأكسجين، الصيغة: ClO 2.
في الظروف العادية، يكون ClO 2 غازًا أصفر محمرًا ذو رائحة مميزة. عند درجات حرارة أقل من 10 درجات مئوية، يكون ClO 2 سائلًا أحمر اللون. منخفض الثبات، ينفجر في الضوء، عند ملامسته للعوامل المؤكسدة وعند تسخينه. دعونا نذوب جيدا في الماء. بسبب خطر الانفجار، لا يمكن تخزين ثاني أكسيد الكلور كسائل.
أكسيد حمضي. عندما يذوب في الماء، يتم تشكيل أحماض الكلوروس والبيركلوريك (تفاعل عدم التناسب). تكون المحاليل المخففة مستقرة في الظلام وتتحلل ببطء في الضوء:
حمض الكلور الناتج غير مستقر للغاية ويتحلل:
يعرض خصائص الأكسدة والاختزال.
2ClO 2 + 5H 2 SO 4 (مخفف) + 10FeSO 4 = 5Fe 2 (SO 4) 3 + 2HCl + 4H 2 O
ClO 2 + 2NaOH بارد. = NaClO2 + NaClO3 + H2O
ClO2 + O3 = ClO3 + O2
يتفاعل ClO 2 مع العديد من المركبات العضوية ويعمل كعامل مؤكسد متوسط القوة.
 حمض تحت الكلور- حمض الهيدروكلوريك (HClO)، وهو حمض أحادي البروتين ضعيف جدًا، حيث يكون للكلور حالة أكسدة قدرها +1. موجود فقط في الحلول.
حمض تحت الكلور- حمض الهيدروكلوريك (HClO)، وهو حمض أحادي البروتين ضعيف جدًا، حيث يكون للكلور حالة أكسدة قدرها +1. موجود فقط في الحلول.
في المحاليل المائية، يتحلل حمض الهيبوكلوروز جزئيًا إلى بروتون وأيون هيبوكلوريت ClO - :
غير مستقر. حمض الهيبوكلوروس وأملاحه - هيبوكلوريت- وكلاء مؤكسدة قوية. يتفاعل مع حمض الهيدروكلوريك حمض الهيدروكلوريك، ويشكل الكلور الجزيئي:
HClO + NaOH (المخفف) = NaClO + H2O 
حمض الكلوروس- حمض الهيدروكلوريك 2، حمض أحادي القاعدة متوسط القوة.
حمض الكلور HClO 2 في شكله الحر غير مستقر، حتى في محلول مائي مخفف فإنه يتحلل بسرعة:
تحييد بواسطة القلويات.
HClO 2 + NaOH (ديل بارد) = NaClO 2 + H 2 O
أنهيدريد هذا الحمض غير معروف.
يتم تحضير المحلول الحمضي من أملاحه - الكلوريتتشكلت نتيجة تفاعل ClO 2 مع القلويات:
يعرض خصائص الأكسدة والاختزال.
5HClO2 + 3H2SO4 (مخفف) + 2KMnO4 = 5HClO3 + 2MnSO4 + K2SO4 + 3H2O
 حمض الكلوريك- حمض الهيدروكلوريك 3، وهو حمض أحادي القاعدة قوي يحتوي فيه الكلور على حالة أكسدة +5. لم يتم تلقيها في شكل حر؛ في المحاليل المائية بتركيزات أقل من 30٪ في البرد تكون مستقرة تمامًا؛ في المحاليل الأكثر تركيزا يتحلل:
حمض الكلوريك- حمض الهيدروكلوريك 3، وهو حمض أحادي القاعدة قوي يحتوي فيه الكلور على حالة أكسدة +5. لم يتم تلقيها في شكل حر؛ في المحاليل المائية بتركيزات أقل من 30٪ في البرد تكون مستقرة تمامًا؛ في المحاليل الأكثر تركيزا يتحلل:
حمض الهيبوكلوروس هو عامل مؤكسد قوي. تزداد قدرة الأكسدة مع زيادة التركيز ودرجة الحرارة. يتم اختزال HClO 3 بسهولة إلى حمض الهيدروكلوريك:
حمض الهيدروكلوريك 3 + 5HCl (مكثف) = 3Cl 2 + 3H 2 O
HClO 3 + NaOH (المخفف) = NaClO 3 + H 2 O
عندما يتم تمرير خليط من ثاني أكسيد الكبريت والهواء من خلال محلول حمضي قوي، يتكون ثاني أكسيد الكلور:
في حمض البيركلوريك 40٪، يشتعل ورق الترشيح، على سبيل المثال.
8. التواجد في الطبيعة:
في القشرة الأرضية، الكلور هو الهالوجين الأكثر شيوعًا. وبما أن الكلور نشط للغاية، فإنه يوجد في الطبيعة فقط على شكل مركبات في المعادن.
الجدول 7. العثور على الطبيعة
الجدول 7. الأشكال المعدنية
توجد أكبر احتياطيات الكلور في أملاح مياه البحار والمحيطات.
إيصال
الطرق الكيميائية لإنتاج الكلور غير فعالة ومكلفة. اليوم لديهم أهمية تاريخية بشكل رئيسي. يمكن الحصول عليه عن طريق تفاعل برمنجنات البوتاسيوم مع حمض الهيدروكلوريك:
طريقة شيلي
في البداية كانت الطريقة الصناعية لإنتاج الكلور تعتمد على طريقة شيلي، أي تفاعل البيرولوزيت مع حمض الهيدروكلوريك:
طريقة الشماس
طريقة لإنتاج الكلور عن طريق الأكسدة الحفزية لكلوريد الهيدروجين مع الأكسجين الجوي.
الطرق الكهروكيميائية
اليوم، يتم إنتاج الكلور على نطاق صناعي مع هيدروكسيد الصوديوم والهيدروجين عن طريق التحليل الكهربائي لمحلول ملح الطعام، ويمكن تمثيل العمليات الرئيسية من خلال الصيغة الموجزة:
طلب
· صفائح النوافذ مصنوعة من البوليمرات المحتوية على الكلور
· المكون الرئيسي للمبيضات هو ماء لاباركو (هيبوكلوريت الصوديوم)
· في إنتاج كلوريد البوليفينيل والمركبات البلاستيكية والمطاط الصناعي.
· إنتاج الكلورين العضوي. يتم استهلاك جزء كبير من الكلور المنتج للحصول على منتجات وقاية النباتات. أحد أهم المبيدات الحشرية هو سداسي كلورو حلقي الهكسان (يُسمى غالبًا سداسي كلوران).
· يُستخدم كعامل حربي كيميائي، وكذلك لإنتاج عوامل حرب كيماوية أخرى: غاز الخردل، والفوسجين.
· لتطهير المياه – “الكلورة”.
· مسجل في صناعة المواد الغذائية كمضاف غذائي E925.
· في الإنتاج الكيميائي لحمض الهيدروكلوريك، والمبيضات، وملح البرثوليت، وكلوريدات المعادن، والسموم، والأدوية، والأسمدة.
· في علم المعادن لإنتاج المعادن النقية: التيتانيوم، القصدير، التنتالوم، النيوبيوم.
· كمؤشر للنيوترينوات الشمسية في كاشفات الكلور والأرجون.
تسعى العديد من البلدان المتقدمة جاهدة للحد من استخدام الكلور في الحياة اليومية، لأسباب منها أن احتراق النفايات المحتوية على الكلور ينتج كمية كبيرة من الديوكسينات.