Tillsats av klor. Att vara i naturen
Klor erhölls troligen av alkemister, men dess upptäckt och första forskning är oupplösligt förknippad med namnet på den berömde svenske kemisten Carl Wilhelm Scheele. Scheele upptäckte fem kemiska grundämnen - barium och mangan (tillsammans med Johan Hahn), molybden, volfram, klor och oberoende av andra kemister (om än senare) - ytterligare tre: syre, väte och kväve. Denna prestation kunde inte upprepas av någon kemist senare. Samtidigt var Scheele, redan invald som ledamot av Kungliga Vetenskapsakademien, en enkel apotekare i Köping, även om han kunde ha tagit en mer hedervärd och prestigefylld ställning. Fredrik II den store själv, den preussiske kungen, erbjöd honom tjänsten som professor i kemi vid universitetet i Berlin. Scheele tackade nej till sådana frestande erbjudanden: "Jag kan inte äta mer än jag behöver, och det jag tjänar här i Köping räcker för mig att äta."
Många klorföreningar var naturligtvis kända långt före Scheele. Detta element är en del av många salter, inklusive det mest kända - bordssalt. 1774 isolerade Scheele klor i fri form genom att värma det svarta mineralet pyrolusit med koncentrerad saltsyra: MnO 2 + 4HCl ® Cl 2 + MnCl 2 + 2H 2 O.
Först ansåg kemister inte klor som ett grundämne, utan som en kemisk förening av det okända elementet muria (från latinets muria - saltlake) med syre. Man trodde att saltsyra (den kallades mursyra) innehåller kemiskt bundet syre. Detta "vittnas" i synnerhet av följande faktum: när en klorlösning stod i ljuset frigjordes syre från den och saltsyra blev kvar i lösningen. Men många försök att "riva" syre från klor ledde ingenstans. Således har ingen kunnat få koldioxid genom att värma klor med kol (som vid höga temperaturer "tar bort" syre från många föreningar som innehåller det). Som ett resultat av liknande experiment utförda av Humphry Davy, Joseph Louis Gay-Lussac och Louis Jacques Thenard blev det klart att klor inte innehåller syre och är ett enkelt ämne. Experimenten av Gay-Lussac, som analyserade det kvantitativa förhållandet av gaser i reaktionen mellan klor och väte, ledde till samma slutsats.
1811 föreslog Davy namnet "klorin" för det nya elementet - från grekiskan. "kloros" - gulgrön. Detta är exakt färgen på klor. Samma rot finns i ordet "klorofyll" (från grekiskans "kloros" och "phyllon" - blad). Ett år senare "kortade" Gay-Lussac namnet till "klor". Men fortfarande kallar britterna (och amerikanerna) detta grundämne "klor", medan fransmännen kallar det klor. Tyskarna, kemins "lagstiftare" under nästan hela 1800-talet, antog också det förkortade namnet. (på tyska är klor klor). 1811 föreslog den tyske fysikern Johann Schweiger namnet "halogen" för klor (från grekiskan "hals" - salt och "gennao" - föder). Därefter tilldelades denna term inte bara klor utan också till alla dess analoger i den sjunde gruppen - fluor, brom, jod, astatin.
Demonstrationen av väteförbränning i en kloratmosfär är intressant: ibland under experimentet uppstår en ovanlig bieffekt: ett surrande ljud hörs. Oftast brummar lågan när ett tunt rör genom vilket väte tillförs sänks ner i ett konformat kärl fyllt med klor; detsamma gäller för sfäriska kolvar, men i cylindrar brummar lågan vanligtvis inte. Detta fenomen kallades den "sjungande lågan".
I en vattenlösning reagerar klor delvis och ganska långsamt med vatten; vid 25°C, jämvikt: Cl 2 + H 2 O HClO + HCl etableras inom två dagar. Hypoklorsyra sönderdelas i ljus: HClO ® HCl + O. Det är atomärt syre som tillskrivs blekningseffekten (absolut torrt klor har inte denna förmåga).
Klor i dess föreningar kan uppvisa alla oxidationstillstånd - från –1 till +7. Med syre bildar klor ett antal oxider, alla i sin rena form är instabila och explosiva: Cl 2 O - gul-orange gas, ClO 2 - gul gas (under 9,7 o C - klarröd vätska), klorperklorat Cl 2 O 4 (ClO –ClO 3, ljusgul vätska), Cl 2 O 6 (O 2 Cl–O–ClO 3, klarröd vätska), Cl 2 O 7 – färglös, mycket explosiv vätska. Vid låga temperaturer erhölls instabila oxider Cl 2 O 3 och ClO 3. ClO 2 oxid produceras i industriell skala och används istället för klor för att bleka massa och desinficera dricksvatten och avloppsvatten. Med andra halogener bildar klor ett antal så kallade interhalogenföreningar, till exempel ClF, ClF 3, ClF 5, BrCl, ICl, ICl 3.
Klor och dess föreningar med positivt oxidationstillstånd är starka oxidationsmedel. År 1822 erhöll den tyske kemisten Leopold Gmelin rött salt från gult blodsalt genom oxidation med klor: 2K 4 + Cl 2 ® K 3 + 2KCl. Klor oxiderar lätt bromider och klorider och frigör brom och jod i fri form.
Klor i olika oxidationstillstånd bildar ett antal syror: HCl - saltsyra (salt, salter - klorider), HClO - hypoklor (salter - hypoklorit), HClO 2 - klor (salter - klorit), HClO 3 - hypoklor (salter - klorater) , HClO 4 – klor (salter – perklorater). Av syresyrorna är endast perklorsyra stabil i sin rena form. Av salterna av syresyror används hypokloriter i praktiken, natriumklorit NaClO 2 - för blekning av tyger, för tillverkning av kompakta pyrotekniska källor för syre ("syreljus"), kaliumklorater (Bertolometasalt), kalcium och magnesium (för bekämpning av skadedjur i jordbruket, som komponenter i pyrotekniska kompositioner och sprängämnen, vid tillverkning av tändstickor), perklorater - komponenter i sprängämnen och pyrotekniska kompositioner; Ammoniumperklorat är en komponent i fasta raketbränslen.
Klor reagerar med många organiska föreningar. Det fäster snabbt till omättade föreningar med dubbla och trippel kol-kol-bindningar (reaktionen med acetylen fortskrider explosivt), och i ljuset till bensen. Under vissa förutsättningar kan klor ersätta väteatomer i organiska föreningar: R–H + Cl 2 ® RCl + HCl. Denna reaktion spelade en betydande roll i den organiska kemins historia. På 1840-talet upptäckte den franske kemisten Jean Baptiste Dumas att när klor reagerar med ättiksyra sker reaktionen med otrolig lätthet
CH3COOH + Cl2® CH2CICOOH + HCl. Med ett överskott av klor bildas triklorättiksyra CCl 3 COOH. Men många kemister var misstroende mot Dumas arbete. I själva verket, enligt den då allmänt accepterade teorin om Berzelius, kunde positivt laddade väteatomer inte ersättas med negativt laddade kloratomer. Denna åsikt hölls vid den tiden av många framstående kemister, bland vilka var Friedrich Wöhler, Justus Liebig och, naturligtvis, Berzelius själv.
För att förlöjliga Dumas överlämnade Wöhler till sin vän Liebig en artikel på uppdrag av en viss S. Windler (Schwindler - på tyska en bedragare) om en ny framgångsrik tillämpning av den reaktion som Dumas påstås ha upptäckt. I artikeln skrev Wöhler med uppenbart hån om hur man i manganacetat Mn(CH 3 COO) 2 kunde ersätta alla grundämnen, enligt deras valens, med klor, vilket resulterade i ett gult kristallint ämne som endast består av klor. Det sades vidare att i England, genom att successivt ersätta alla atomer i organiska föreningar med kloratomer, omvandlas vanliga tyger till klor, och att saker samtidigt behåller sitt utseende. I en fotnot stod det att Londonbutiker sålde en livlig handel med material som enbart bestod av klor, eftersom detta material var mycket bra för sängmössor och varma kalsonger.
Reaktionen av klor med organiska föreningar leder till bildning av många organiska klorprodukter, bland vilka är de allmänt använda lösningsmedlen metylenklorid CH 2 Cl 2, kloroform CHCl 3, koltetraklorid CCl 4, trikloretylen CHCl=CCl 2, tetrakloretylen C 2 Cl 4 . I närvaro av fukt missfärgar klor de gröna bladen på växter och många färgämnen. Detta användes redan på 1700-talet. för blekning av tyger.
Klor som en giftig gas.
Scheele, som fick klor, noterade en mycket obehaglig stark lukt, andningssvårigheter och hosta. Som vi senare fick reda på, luktar en person klor även om en liter luft bara innehåller 0,005 mg av denna gas, och samtidigt har den redan en irriterande effekt på luftvägarna och förstör cellerna i slemhinnan i andningsorganen. tarmkanalen och lungorna. En koncentration på 0,012 mg/l är svår att tolerera; om koncentrationen av klor överstiger 0,1 mg/l blir det livshotande: andningen påskyndar, blir krampaktig och blir sedan allt mer sällsynt och efter 5–25 minuter upphör andningen. Den högsta tillåtna koncentrationen i luften i industriföretag är 0,001 mg/l och i luften i bostadsområden - 0,00003 mg/l.
S:t Petersburgs akademiker Toviy Egorovich Lovitz, som upprepade Scheeles experiment 1790, släppte av misstag ut en betydande mängd klor i luften. Efter att ha andats in det tappade han medvetandet och föll och led sedan av olidliga bröstsmärtor i åtta dagar. Som tur var återhämtade han sig. Den berömda engelske kemisten Davy dog nästan av klorförgiftning. Experiment med även små mängder klor är farliga, eftersom de kan orsaka allvarliga lungskador. De säger att den tyske kemisten Egon Wiberg inledde en av sina föreläsningar om klor med orden: ”Klor är en giftig gas. Om jag blir förgiftad under nästa demonstration, snälla ta mig ut i friska luften. Men tyvärr måste föreläsningen avbrytas.” Om du släpper ut mycket klor i luften blir det en riktig katastrof. Detta upplevde de anglo-franska trupperna under första världskriget. På morgonen den 22 april 1915 beslutade det tyska kommandot att genomföra den första gasattacken i krigshistorien: när vinden blåste mot fienden, på en liten sex kilometer lång sektion av fronten nära den belgiska staden Ypres ventilerna på 5 730 cylindrar öppnades samtidigt, var och en innehållande 30 kg flytande klor. Inom 5 minuter bildades ett enormt gulgrönt moln som sakta rörde sig bort från de tyska skyttegravarna mot de allierade. De engelska och franska soldaterna var helt försvarslösa. Gasen trängde genom springorna in i alla skyddsrum, det fanns ingen flykt från den: gasmasken hade trots allt inte uppfunnits ännu. Som ett resultat förgiftades 15 tusen människor, 5 tusen av dem till döds. En månad senare, den 31 maj, upprepade tyskarna gasattacken på östfronten – mot ryska trupper. Detta hände i Polen nära staden Bolimova. Vid 12 km-fronten släpptes 264 ton av en blandning av klor och mycket giftigare fosgen (kolsyraklorid COCl 2) från 12 tusen cylindrar. Tsarkommandot visste om vad som hände i Ypres, och ändå hade de ryska soldaterna inga medel till försvar! Till följd av gasattacken uppgick förlusterna till 9 146 personer, varav endast 108 till följd av gevärs- och artilleribeskjutning, resten förgiftades. Samtidigt dog 1 183 personer nästan omedelbart.
Snart visade kemister hur man flyr från klor: du måste andas genom en gasbinda indränkt i en lösning av natriumtiosulfat (det här ämnet används i fotografering, det kallas ofta hyposulfit). Klor reagerar mycket snabbt med en tiosulfatlösning och oxiderar den:
Na2S2O3 + 4Cl2 + 5H2O® 2H2SO4 + 2NaCl + 6HCl. Naturligtvis är svavelsyra inte heller ett ofarligt ämne, men dess utspädda vattenlösning är mycket mindre farlig än giftigt klor. Därför hade tiosulfat under dessa år ett annat namn - "antiklor", men de första tiosulfatgasmaskerna var inte särskilt effektiva.
1916 uppfann den ryske kemisten och framtida akademikern Nikolai Dmitrievich Zelinsky en verkligt effektiv gasmask, där giftiga ämnen hölls kvar av ett lager av aktivt kol. Sådant kol med en mycket utvecklad yta skulle kunna behålla betydligt mer klor än gasväv indränkt i hyposulfit. Lyckligtvis förblev "klorattackerna" bara en tragisk episod i historien. Efter världskriget hade klor bara fredliga yrken kvar.
Användning av klor.
Varje år produceras enorma mängder klor över hela världen – tiotals miljoner ton. Endast i USA i slutet av 1900-talet. Cirka 12 miljoner ton klor producerades årligen genom elektrolys (10:e plats bland kemisk produktion). Huvuddelen av det (upp till 50%) går åt till klorering av organiska föreningar - för att producera lösningsmedel, syntetiskt gummi, polyvinylklorid och andra plaster, kloroprengummi, bekämpningsmedel, mediciner och många andra nödvändiga och användbara produkter. Resten konsumeras för syntes av oorganiska klorider, inom massa- och pappersindustrin för blekning av trämassa och för vattenrening. Klor används i relativt små mängder inom den metallurgiska industrin. Med dess hjälp erhålls mycket rena metaller - titan, tenn, tantal, niob. Genom att bränna väte i klor, erhålls väteklorid, och från det erhålls saltsyra. Klor används också för framställning av blekmedel (hypoklorit, blekmedel) och vattendesinfektion genom klorering.
Ilya Leenson
DEFINITION
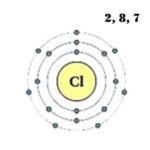
Klor- det sjuttonde elementet i det periodiska systemet. Beteckning - Cl från det latinska "chlorum". Beläget i den tredje perioden, VIIA-gruppen. Avser icke-metaller. Kärnladdningen är 17.
Den viktigaste naturliga klorföreningen är natriumklorid (bordssalt) NaCl. Huvudmassan av natriumklorid finns i vattnet i haven och oceanerna. Vattnet i många sjöar innehåller också betydande mängder NaCl. Det finns också i fast form och bildar på platser i jordskorpan tjocka lager av så kallat stensalt. Andra klorföreningar är också vanliga i naturen, till exempel kaliumklorid i form av mineralerna karnalit KCl × MgCl 2 × 6H 2 O och sylvit KCl.
Under normala förhållanden är klor en gulgrön gas (Fig. 1), som är mycket löslig i vatten. När de kyls frigörs kristallina hydrater från vattenlösningar, som är klarater med den ungefärliga sammansättningen Cl 2 × 6H 2 O och Cl 2 × 8H 2 O.
Ris. 1. Klor i flytande tillstånd. Utseende.
Atom- och molekylmassa av klor
Den relativa atommassan för ett grundämne är förhållandet mellan massan av en atom av ett givet grundämne och 1/12 av massan av en kolatom. Relativ atommassa är dimensionslös och betecknas med A r (indexet "r" är initialbokstaven i det engelska ordet relativ, vilket betyder "relativ"). Den relativa atommassan för atomär klor är 35,457 amu.
Massorna av molekyler, såväl som massorna av atomer, uttrycks i atommassaenheter. Molekylmassan för ett ämne är massan av en molekyl, uttryckt i atommassaenheter. Den relativa molekylmassan för ett ämne är förhållandet mellan massan av en molekyl av ett givet ämne och 1/12 av massan av en kolatom, vars massa är 12 amu. Det är känt att klormolekylen är diatomisk - Cl 2. Den relativa molekylvikten för en klormolekyl kommer att vara lika med:
Mr (Cl2) = 35,457 x 2 ≈ 71.
Isotoper av klor
Det är känt att i naturen kan klor hittas i form av två stabila isotoper 35 Cl (75,78%) och 37 Cl (24,22%). Deras massnummer är 35 respektive 37. Kärnan i en atom i klorisotopen 35 Cl innehåller sjutton protoner och arton neutroner, och isotopen 37 Cl innehåller samma antal protoner och tjugo neutroner.
Det finns konstgjorda isotoper av klor med masstal från 35 till 43, bland vilka den mest stabila är 36 Cl med en halveringstid på 301 tusen år.
Klorjoner
Den yttre energinivån hos kloratomen har sju elektroner, som är valenselektroner:
1s 2 2s 2 2p 6 3s 2 3p 5 .
Som ett resultat av kemisk interaktion kan klor förlora sina valenselektroner, d.v.s. vara deras donator, och förvandlas till positivt laddade joner eller ta emot elektroner från en annan atom, d.v.s. vara deras acceptor och förvandlas till negativt laddade joner:
C10-7e → Cl7+;
C10-5e → Cl5+;
C10-4e → Cl4+;
C10-3e → Cl3+;
C10-2e → Cl2+;
C10-1e → Cl1+;
CI0+1e → Cl1-.
Klormolekyl och atom
Klormolekylen består av två atomer - Cl 2. Här är några egenskaper som kännetecknar kloratomen och molekylen:
Exempel på problemlösning
EXEMPEL 1
| Träning | Vilken volym klor måste tas för att reagera med 10 liter väte? Gaser är under samma förhållanden. |
| Lösning | Låt oss skriva ekvationen för reaktionen mellan klor och väte: Cl2 + H2 = 2HCl. Låt oss beräkna mängden väteämne som reagerade: n (H2) = V(H2)/Vm; n (H2) = 10/22,4 = 0,45 mol. Enligt ekvationen är n (H 2) = n (Cl 2) = 0,45 mol. Då är volymen klor som reagerade med väte lika med: |
De fysikaliska egenskaperna hos klor beaktas: klors densitet, dess värmeledningsförmåga, specifik värme och dynamisk viskositet vid olika temperaturer. De fysikaliska egenskaperna hos Cl 2 presenteras i form av tabeller för de flytande, fasta och gasformiga tillstånden för denna halogen.
Grundläggande fysikaliska egenskaper hos klor
Klor ingår i grupp VII av den tredje perioden av det periodiska systemet för element vid nummer 17. Det tillhör undergruppen av halogener, har relativa atom- och molekylmassor på 35.453 respektive 70.906. Vid temperaturer över -30°C är klor en gröngul gas med en karakteristisk stark, irriterande lukt. Den smälter lätt under normalt tryck (1,013·10 5 Pa) när den kyls till -34°C och bildar en klar bärnstensfärgad vätska som stelnar vid -101°C.
På grund av sin höga kemiska aktivitet förekommer inte fritt klor i naturen, utan finns endast i form av föreningar. Det finns huvudsakligen i mineralet halit (), och ingår också i sådana mineraler som sylvit (KCl), karnalit (KCl MgCl 2 6H 2 O) och sylvinit (KCl NaCl). Klorinhalten i jordskorpan närmar sig 0,02 % av det totala antalet atomer i jordskorpan, där det finns i form av två isotoper 35 Cl och 37 Cl i ett procentuellt förhållande av 75,77 % 35 Cl och 24,23 % 37 Cl .
| Fast egendom | Menande |
|---|---|
| Smältpunkt, °C | -100,5 |
| Kokpunkt, °C | -30,04 |
| Kritisk temperatur, °C | 144 |
| Kritisk press, Pa | 77,1 10 5 |
| Kritisk densitet, kg/m 3 | 573 |
| Gasdensitet (vid 0°C och 1,013 10 5 Pa), kg/m 3 | 3,214 |
| Mättad ångdensitet (vid 0°C och 3,664 10 5 Pa), kg/m 3 | 12,08 |
| Densitet av flytande klor (vid 0°C och 3,664 10 5 Pa), kg/m 3 | 1468 |
| Densitet av flytande klor (vid 15,6°C och 6,08 10 5 Pa), kg/m 3 | 1422 |
| Densitet av fast klor (vid -102°C), kg/m 3 | 1900 |
| Relativ densitet av gas i luft (vid 0°C och 1,013 10 5 Pa) | 2,482 |
| Relativ densitet av mättad ånga i luft (vid 0°C och 3,664 10 5 Pa) | 9,337 |
| Relativ densitet av flytande klor vid 0°C (relativt vatten vid 4°C) | 1,468 |
| Specifik volym gas (vid 0°C och 1,013 10 5 Pa), m 3 /kg | 0,3116 |
| Specifik volym mättad ånga (vid 0°C och 3,664 10 5 Pa), m 3 /kg | 0,0828 |
| Specifik volym flytande klor (vid 0°C och 3,664 10 5 Pa), m 3 /kg | 0,00068 |
| Klorångtryck vid 0°C, Pa | 3,664 10 5 |
| Dynamisk viskositet för gas vid 20°C, 10 -3 Pa s | 0,013 |
| Dynamisk viskositet för flytande klor vid 20°C, 10 -3 Pa s | 0,345 |
| Smältvärme av fast klor (vid smältpunkt), kJ/kg | 90,3 |
| Förångningsvärme (vid kokpunkten), kJ/kg | 288 |
| Sublimeringsvärme (vid smältpunkt), kJ/mol | 29,16 |
| Molär värmekapacitet C p för gas (vid -73…5727°C), J/(mol K) | 31,7…40,6 |
| Molär värmekapacitet C p av flytande klor (vid -101…-34°C), J/(mol K) | 67,1…65,7 |
| Gasens värmeledningskoefficient vid 0°C, W/(m K) | 0,008 |
| Värmeledningskoefficient för flytande klor vid 30°C, W/(m K) | 0,62 |
| Gasentalpi, kJ/kg | 1,377 |
| Entalpi av mättad ånga, kJ/kg | 1,306 |
| Entalpi av flytande klor, kJ/kg | 0,879 |
| Brytningsindex vid 14°C | 1,367 |
| Specifik elektrisk ledningsförmåga vid -70°С, S/m | 10 -18 |
| Elektronaffinitet, kJ/mol | 357 |
| Joniseringsenergi, kJ/mol | 1260 |
Klordensitet
Under normala förhållanden är klor en tung gas med en densitet som är ungefär 2,5 gånger högre. Densitet av gasformigt och flytande klor under normala förhållanden (vid 0°C) är lika med 3,214 respektive 1468 kg/m3. När flytande eller gasformigt klor värms upp, minskar dess densitet på grund av en ökning i volym på grund av termisk expansion.
Densitet av klorgas
Tabellen visar densiteten av klor i gasform vid olika temperaturer (från -30 till 140°C) och normalt atmosfärstryck (1,013·10 5 Pa). Klorens densitet ändras med temperaturen - den minskar när den värms upp. Till exempel, vid 20°C är densiteten av klor 2,985 kg/m3, och när temperaturen på denna gas ökar till 100°C, minskar densitetsvärdet till ett värde av 2,328 kg/m3.
| t, °С | ρ, kg/m 3 | t, °С | ρ, kg/m 3 |
|---|---|---|---|
| -30 | 3,722 | 60 | 2,616 |
| -20 | 3,502 | 70 | 2,538 |
| -10 | 3,347 | 80 | 2,464 |
| 0 | 3,214 | 90 | 2,394 |
| 10 | 3,095 | 100 | 2,328 |
| 20 | 2,985 | 110 | 2,266 |
| 30 | 2,884 | 120 | 2,207 |
| 40 | 2,789 | 130 | 2,15 |
| 50 | 2,7 | 140 | 2,097 |
När trycket ökar, ökar densiteten av klor. Tabellerna nedan visar densiteten för klorgas i temperaturområdet från -40 till 140°C och tryck från 26,6·10 5 till 213·10 5 Pa. Med ökande tryck ökar densiteten av klor i gasformigt tillstånd proportionellt. Till exempel leder en ökning av klortrycket från 53,2·105 till 106,4·105 Pa vid en temperatur av 10°C till en dubbel ökning av densiteten för denna gas.
| ↓ t, °С | P, kPa → | 26,6 | 53,2 | 79,8 | 101,3 |
|---|---|---|---|---|
| -40 | 0,9819 | 1,996 | — | — |
| -30 | 0,9402 | 1,896 | 2,885 | 3,722 |
| -20 | 0,9024 | 1,815 | 2,743 | 3,502 |
| -10 | 0,8678 | 1,743 | 2,629 | 3,347 |
| 0 | 0,8358 | 1,678 | 2,528 | 3,214 |
| 10 | 0,8061 | 1,618 | 2,435 | 3,095 |
| 20 | 0,7783 | 1,563 | 2,35 | 2,985 |
| 30 | 0,7524 | 1,509 | 2,271 | 2,884 |
| 40 | 0,7282 | 1,46 | 2,197 | 2,789 |
| 50 | 0,7055 | 1,415 | 2,127 | 2,7 |
| 60 | 0,6842 | 1,371 | 2,062 | 2,616 |
| 70 | 0,6641 | 1,331 | 2 | 2,538 |
| 80 | 0,6451 | 1,292 | 1,942 | 2,464 |
| 90 | 0,6272 | 1,256 | 1,888 | 2,394 |
| 100 | 0,6103 | 1,222 | 1,836 | 2,328 |
| 110 | 0,5943 | 1,19 | 1,787 | 2,266 |
| 120 | 0,579 | 1,159 | 1,741 | 2,207 |
| 130 | 0,5646 | 1,13 | 1,697 | 2,15 |
| 140 | 0,5508 | 1,102 | 1,655 | 2,097 |
| ↓ t, °С | P, kPa → | 133 | 160 | 186 | 213 |
|---|---|---|---|---|
| -20 | 4,695 | 5,768 | — | — |
| -10 | 4,446 | 5,389 | 6,366 | 7,389 |
| 0 | 4,255 | 5,138 | 6,036 | 6,954 |
| 10 | 4,092 | 4,933 | 5,783 | 6,645 |
| 20 | 3,945 | 4,751 | 5,565 | 6,385 |
| 30 | 3,809 | 4,585 | 5,367 | 6,154 |
| 40 | 3,682 | 4,431 | 5,184 | 5,942 |
| 50 | 3,563 | 4,287 | 5,014 | 5,745 |
| 60 | 3,452 | 4,151 | 4,855 | 5,561 |
| 70 | 3,347 | 4,025 | 4,705 | 5,388 |
| 80 | 3,248 | 3,905 | 4,564 | 5,225 |
| 90 | 3,156 | 3,793 | 4,432 | 5,073 |
| 100 | 3,068 | 3,687 | 4,307 | 4,929 |
| 110 | 2,985 | 3,587 | 4,189 | 4,793 |
| 120 | 2,907 | 3,492 | 4,078 | 4,665 |
| 130 | 2,832 | 3,397 | 3,972 | 4,543 |
| 140 | 2,761 | 3,319 | 3,87 | 4,426 |
Densitet av flytande klor
Flytande klor kan existera i ett relativt snävt temperaturområde, vars gränser ligger från minus 100,5 till plus 144 ° C (det vill säga från smältpunkten till den kritiska temperaturen). Över en temperatur på 144°C förvandlas klor inte till flytande tillstånd under något tryck. Densiteten av flytande klor i detta temperaturområde varierar från 1717 till 573 kg/m3.
| t, °С | ρ, kg/m 3 | t, °С | ρ, kg/m 3 |
|---|---|---|---|
| -100 | 1717 | 30 | 1377 |
| -90 | 1694 | 40 | 1344 |
| -80 | 1673 | 50 | 1310 |
| -70 | 1646 | 60 | 1275 |
| -60 | 1622 | 70 | 1240 |
| -50 | 1598 | 80 | 1199 |
| -40 | 1574 | 90 | 1156 |
| -30 | 1550 | 100 | 1109 |
| -20 | 1524 | 110 | 1059 |
| -10 | 1496 | 120 | 998 |
| 0 | 1468 | 130 | 920 |
| 10 | 1438 | 140 | 750 |
| 20 | 1408 | 144 | 573 |
Specifik värmekapacitet av klor
Den specifika värmekapaciteten för klorgas C p i kJ/(kg K) i temperaturområdet från 0 till 1200°C och normalt atmosfärstryck kan beräknas med formeln:
där T är den absoluta temperaturen för klor i grader Kelvin.
Det bör noteras att under normala förhållanden är den specifika värmekapaciteten för klor 471 J/(kg K) och ökar vid uppvärmning. Ökningen av värmekapaciteten vid temperaturer över 500°C blir obetydlig, och vid höga temperaturer förblir den specifika värmen hos klor praktiskt taget oförändrad.
Tabellen visar resultaten av beräkningen av den specifika värmen för klor med hjälp av formeln ovan (beräkningsfelet är cirka 1%).
| t, °С | C p , J/(kg K) | t, °С | C p , J/(kg K) |
|---|---|---|---|
| 0 | 471 | 250 | 506 |
| 10 | 474 | 300 | 508 |
| 20 | 477 | 350 | 510 |
| 30 | 480 | 400 | 511 |
| 40 | 482 | 450 | 512 |
| 50 | 485 | 500 | 513 |
| 60 | 487 | 550 | 514 |
| 70 | 488 | 600 | 514 |
| 80 | 490 | 650 | 515 |
| 90 | 492 | 700 | 515 |
| 100 | 493 | 750 | 515 |
| 110 | 494 | 800 | 516 |
| 120 | 496 | 850 | 516 |
| 130 | 497 | 900 | 516 |
| 140 | 498 | 950 | 516 |
| 150 | 499 | 1000 | 517 |
| 200 | 503 | 1100 | 517 |
Vid temperaturer nära absolut noll är klor i fast tillstånd och har en låg specifik värmekapacitet (19 J/(kg K)). När temperaturen på fast Cl2 ökar, ökar dess värmekapacitet och når ett värde av 720 J/(kg K) vid minus 143°C.
Flytande klor har en specifik värmekapacitet på 918...949 J/(kg K) i intervallet från 0 till -90 grader Celsius. Enligt tabellen kan man se att den specifika värmekapaciteten för flytande klor är högre än för gasformigt klor och minskar med ökande temperatur.
Värmeledningsförmåga hos klor
Tabellen visar värdena för värmeledningskoefficienterna för klorgas vid normalt atmosfärstryck i temperaturområdet från -70 till 400°C.
Den termiska konduktivitetskoefficienten för klor under normala förhållanden är 0,0079 W/(m deg), vilket är 3 gånger mindre än vid samma temperatur och tryck. Uppvärmning av klor leder till en ökning av dess värmeledningsförmåga. Sålunda, vid en temperatur av 100°C, ökar värdet av denna fysiska egenskap hos klor till 0,0114 W/(m deg).
| t, °С | λ, W/(m grader) | t, °С | λ, W/(m grader) |
|---|---|---|---|
| -70 | 0,0054 | 50 | 0,0096 |
| -60 | 0,0058 | 60 | 0,01 |
| -50 | 0,0062 | 70 | 0,0104 |
| -40 | 0,0065 | 80 | 0,0107 |
| -30 | 0,0068 | 90 | 0,0111 |
| -20 | 0,0072 | 100 | 0,0114 |
| -10 | 0,0076 | 150 | 0,0133 |
| 0 | 0,0079 | 200 | 0,0149 |
| 10 | 0,0082 | 250 | 0,0165 |
| 20 | 0,0086 | 300 | 0,018 |
| 30 | 0,009 | 350 | 0,0195 |
| 40 | 0,0093 | 400 | 0,0207 |
Klorviskositet
Den dynamiska viskositetskoefficienten för gasformigt klor i temperaturområdet 20...500°C kan ungefär beräknas med formeln:
där η T är koefficienten för dynamisk viskositet för klor vid en given temperatur T, K;
η T 0 - koefficient för dynamisk viskositet av klor vid temperatur T 0 = 273 K (vid normala förhållanden);
C är Sutherlands konstant (för klor C = 351).
Under normala förhållanden är den dynamiska viskositeten för klor 0,0123·10 -3 Pa·s. Vid upphettning får klorets fysiska egenskaper, såsom viskositet, högre värden.
Flytande klor har en viskositet som är en storleksordning högre än gasformigt klor. Till exempel, vid en temperatur av 20°C, har den dynamiska viskositeten för flytande klor ett värde av 0,345·10 -3 Pa·s och minskar med ökande temperatur.
Källor:
- Barkov S. A. Halogener och manganundergruppen. Element i grupp VII i det periodiska systemet för D. I. Mendeleev. En manual för studenter. M.: Utbildning, 1976 - 112 sid.
- Tabeller över fysiska storheter. Katalog. Ed. acad. I. K. Kikoina. M.: Atomizdat, 1976 - 1008 sid.
- Yakimenko L. M., Pasmanik M. I. Handbok om tillverkning av klor, kaustiksoda och basprodukter av klor. Ed. 2:a, per. och andra M.: Chemistry, 1976 - 440 sid.
Klor erhölls först 1772 av Scheele, som beskrev dess frisättning under interaktionen av pyrolusit med saltsyra i sin avhandling om pyrolusit: 4HCl + MnO 2 = Cl 2 + MnCl 2 + 2H 2 O
Scheele noterade lukten av klor, liknande den av aqua regia, dess förmåga att reagera med guld och cinnober, och dess blekningsegenskaper. Scheele föreslog dock, i enlighet med flogistonteorin som var dominerande inom kemin vid den tiden, att klor är avflogistikerad saltsyra, det vill säga oxiden av saltsyra.
Berthollet och Lavoisier föreslog att klor är en oxid av grundämnet muria, men försök att isolera det förblev misslyckade tills Davys arbete, som lyckades bryta ner bordssalt till natrium och klor genom elektrolys.
Namnet på elementet kommer från grekiskan clwroz- "grönt".
Att vara i naturen, ta emot:
Naturligt klor är en blandning av två isotoper 35 Cl och 37 Cl. I jordskorpan är klor den vanligaste halogenen. Eftersom klor är mycket aktivt förekommer det i naturen endast i form av föreningar i mineralerna: halit NaCl, sylvit KCl, sylvinit KCl NaCl, bischofit MgCl 2 6H 2 O, karnalit KCl MgCl 2 6H 2 O, kainit KCl MgSO 4 · 3H 2 O. De största reserverna av klor finns i salterna i havens och oceanernas vatten.
I industriell skala produceras klor tillsammans med natriumhydroxid och väte genom elektrolys av en lösning av bordssalt:
2NaCl + 2H2O => H2 + Cl2 + 2NaOH
För att återvinna klor från klorväte, som är en biprodukt vid industriell klorering av organiska föreningar, används Deacon-processen (katalytisk oxidation av klorväte med atmosfäriskt syre):
4HCl + O2 = 2H2O + 2Cl2
Processer som vanligtvis används i laboratorier är baserade på oxidation av väteklorid med starka oxidationsmedel (till exempel mangan(IV)oxid, kaliumpermanganat, kaliumdikromat):
2KMnO4 + 16HCl = 5Cl2 + 2MnCl2 + 2KCl +8H2O
K2Cr2O7 + 14HCl = 3Cl2 + 2CrCl3 + 2KCl + 7H2O
Fysikaliska egenskaper:
Under normala förhållanden är klor en gulgrön gas med en kvävande lukt. Klor är märkbart lösligt i vatten ("klorvatten"). Vid 20°C löses 2,3 volymer klor i en volym vatten. Kokpunkt = -34°C; smältpunkt = -101°C, densitet (gas, n.s.) = 3,214 g/l.
Kemiska egenskaper:
Klor är mycket aktivt - det kombineras direkt med nästan alla element i det periodiska systemet, metaller och icke-metaller (förutom kol, kväve, syre och inerta gaser). Klor är ett mycket starkt oxidationsmedel som ersätter mindre aktiva icke-metaller (brom, jod) från deras föreningar med väte och metaller:
Cl2 + 2HBr = Br2 + 2HCl; Cl2 + 2NaI = I2 + 2NaCl
När det löses i vatten eller alkalier, dismuterar klor och bildar hypoklor (och vid upphettning, perklorsyra) och saltsyror, eller deras salter.
Cl2 + H2O HClO + HCl;
Klor interagerar med många organiska föreningar och går in i substitutions- eller additionsreaktioner:
CH3-CH3 + xCl2 => C2H 6-x Cl x + xHCl
CH2=CH2 + Cl2 => Cl-CH2-CH2-Cl
C6H6 + Cl2 => C6H6Cl + HCl
Klor har sju oxidationstillstånd: -1, 0, +1, +3, +4, +5, +7.
De viktigaste anslutningarna:
Klorväte HCl- en färglös gas som ryker i luften på grund av bildandet av dimdroppar med vattenånga. Den har en stickande lukt och irriterar kraftigt luftvägarna. Ingår i vulkaniska gaser och vatten, i magsaft. Kemiska egenskaper beror på vilket tillstånd det är i (kan vara i gasformigt, flytande eller lösningstillstånd). HCl-lösningen kallas saltsyra. Det är en stark syra och tränger undan svagare syror från sina salter. Salter - klorider- fasta kristallina ämnen med höga smältpunkter.
Kovalenta klorider- klorföreningar med icke-metaller, gaser, vätskor eller smältbara fasta ämnen som har karakteristiska sura egenskaper, vanligtvis lätt hydrolyserade av vatten för att bilda saltsyra:
PCl5 + 4H2O = H3P04 + 5HCl;
Klor(I)oxid Cl 2 O., en gas av brungul färg med en stickande lukt. Påverkar andningsorganen. Löser sig lätt i vatten och bildar underklorsyra.
Hypoklorsyra HClO. Finns bara i lösningar. Det är en svag och instabil syra. Bryts lätt ned till saltsyra och syre. Starkt oxidationsmedel. Bildas när klor löses i vatten. Salter - hypokloriter, låg stabilitet (NaClO*H 2 O sönderdelas explosivt vid 70 °C), starka oxidationsmedel. Används ofta för blekning och desinfektion blekningspulver blandat salt Ca(Cl)OCl
Klorsyra HClO 2, i sin fria form är instabil, även i en utspädd vattenlösning sönderdelas den snabbt. Medelstark syra, salter - kloriter som regel är färglösa och mycket lösliga i vatten. Till skillnad från hypokloriter uppvisar kloriter uttalade oxiderande egenskaper endast i en sur miljö. Den största användningen (för blekning av tyger och pappersmassa) är natriumklorit NaClO 2.
Klor(IV)oxid ClO2, är en gröngul gas med en obehaglig (stickande) lukt, ...
Klorsyra, HClO 3 - i sin fria form är instabil: det disproportioneras till ClO 2 och HClO 4. Salter - klorater; Av dessa är de viktigaste natrium-, kalium-, kalcium- och magnesiumkloraterna. Dessa är starka oxidationsmedel och är explosiva när de blandas med reduktionsmedel. Kaliumklorat ( Berthollets salt) - KClO 3, användes för att producera syre i laboratoriet, men på grund av dess höga fara användes det inte längre. Lösningar av kaliumklorat användes som ett svagt antiseptiskt medel och extern medicinsk gurgel.
Perklorsyra HClO 4, i vattenlösningar är perklorsyra den mest stabila av alla syrehaltiga klorsyror. Vattenfri perklorsyra, som erhålls med koncentrerad svavelsyra från 72 % HClO 4, är inte särskilt stabil. Det är den starkaste monoprotiska syran (i vattenlösning). Salter - perklorater, används som oxidationsmedel (raketmotorer för fasta drivmedel).
Ansökan:
Klor används i många industrier, vetenskap och hushållsbehov:
- Vid tillverkning av polyvinylklorid, plastföreningar, syntetiskt gummi;
- För blekning av tyg och papper;
- Produktion av organoklorinsekticider - ämnen som dödar insekter som är skadliga för grödor, men är säkra för växter;
- För vattendesinfektion - "klorering";
- Registrerad i livsmedelsindustrin som en livsmedelstillsats E925;
- Vid kemisk produktion av saltsyra, blekmedel, bertholletsalt, metallklorider, gifter, droger, gödningsmedel;
- Inom metallurgi för framställning av rena metaller: titan, tenn, tantal, niob.
Biologisk roll och toxicitet:
Klor är ett av de viktigaste biogena elementen och är en del av alla levande organismer. Hos djur och människor är klorjoner involverade i att upprätthålla osmotisk balans, kloridjonen har en optimal radie för penetration genom cellmembranet. Klorjoner är avgörande för växter, deltar i energimetabolismen i växter, aktiverar oxidativ fosforylering.
Klor i form av ett enkelt ämne är giftigt, om det kommer in i lungorna orsakar det brännskador av lungvävnad och kvävning. Det har en irriterande effekt på andningsvägarna vid en koncentration i luften på cirka 0,006 mg/l (dvs två gånger tröskeln för uppfattningen av lukten av klor). Klor var ett av de första kemiska medlen som användes av Tyskland under första världskriget.
Korotkova Y., Shvetsova I.
HF Tyumen State University, 571 grupp.
Källor: Wikipedia: http://ru.wikipedia.org/wiki/Cl, etc.,
Webbplats för det ryska kemiska tekniska universitetet uppkallad efter. D.I. Mendeleev:
Egenskaper för element i grupp VII i huvudundergruppen, med klor som exempel
Allmänna egenskaper hos undergruppen
Tabell 1. Nomenklatur för element i undergrupp VIIA
P-element, typiska, icke-metaller (astatin är en halvmetall), halogener.
Elektrondiagram för elementet Hal (Hal ≠ F):
Elementen i undergrupp VIIA kännetecknas av följande valenser:
Tabell 2. Valens
3. Elementen i undergrupp VIIA kännetecknas av följande oxidationstillstånd:
Tabell 3. Oxidationstillstånd för grundämnen
Egenskaper hos ett kemiskt element
Klor är ett element i grupp VII A. Serienummer 17
Relativ atommassa: 35,4527 a. e.m. (g/mol)
 Antal protoner, neutroner, elektroner: 17,18,17
Antal protoner, neutroner, elektroner: 17,18,17
Atomstruktur:
![]()
Elektronisk formel:
Typiska oxidationstillstånd: -1, 0, +1, +3, +4, +5, +7
Joniseringsenergi: 1254,9 (13,01) kJ/mol (eV)
Elektronaffinitet: 349 (kJ/mol)
Elektronegativitet enligt Pauling: 3.20
Egenskaper för ett enkelt ämne
Bindningstyp: kovalent icke-polär
Diatomisk molekyl
Isotoper: 35 Cl (75,78 %) och 37 Cl (24,22 %)
Kristallgittertyp: molekylär
Termodynamiska parametrar
Tabell 4
Fysikaliska egenskaper
Tabell 5
Kemiska egenskaper
En vattenlösning av klor är mycket dismuterad ("klorvatten")
Steg 1: Cl2 + H2O = HCl + HOCl
Steg 2: HOCl = HCl + [O] – atomärt syre
Oxidationsförmågan i undergruppen minskar från fluor till jod = ˃
Klor är ett starkt oxidationsmedel:
1. Interaktion med enkla ämnen
a) med väte:
Cl2 + H2 = 2HCl
b) med metaller:
Cl2 + 2Na = 2NaCl
3Cl2 + 2Fe = 2FeCl3
c) med några mindre elektronegativa ickemetaller:
3Cl2 + 2P = 2PCl 3
Cl2 + S = SCl2
Med syre, kol och kväve, klor direkt reagerar inte!
2. Interaktion med komplexa ämnen
a) med vatten: se ovan
b) med syror: reagerar inte!
c) med alkaliska lösningar:
i kyla: Cl 2 + 2 NaOH = NaCl + NaClO + H 2 O
vid upphettning: 3Cl2 + 6 KOH = 5KCl + KClO3 + 3H2O
e) med många organiska ämnen:
Cl2 + CH4 = CH3Cl + HCl
C6H6 + Cl2 = C6H5CI + HCl
De viktigaste klorföreningarna
 Klorväte, klorväte(HCl) är en färglös, termiskt stabil gas (under normala förhållanden) med en stickande lukt, ångor i fuktig luft, löser sig lätt i vatten (upp till 500 volymer gas per volym vatten) för att bilda saltsyra (saltsyra). Vid -114,22 °C förvandlas HCl till ett fast tillstånd. I fast tillstånd existerar klorväte i form av två kristallina modifikationer: ortorombisk, stabil under och kubisk.
Klorväte, klorväte(HCl) är en färglös, termiskt stabil gas (under normala förhållanden) med en stickande lukt, ångor i fuktig luft, löser sig lätt i vatten (upp till 500 volymer gas per volym vatten) för att bilda saltsyra (saltsyra). Vid -114,22 °C förvandlas HCl till ett fast tillstånd. I fast tillstånd existerar klorväte i form av två kristallina modifikationer: ortorombisk, stabil under och kubisk.
En vattenlösning av väteklorid kallas saltsyra. När det löses i vatten sker följande processer:
HCl g + H 2 O 1 = H 3 O + 1 + Cl − 1
Upplösningsprocessen är mycket exoterm. Med vatten bildar HCl en azeotrop blandning. Det är en stark monoprotisk syra. Interagerar energiskt med alla metaller i spänningsserien till vänster om väte, med basiska och amfotära oxider, baser och salter, bildar salter - klorider:
Mg + 2 HCl → MgCl2 + H2
FeO + 2 HCl → FeCl2 + H2O
Vid exponering för starka oxidationsmedel eller under elektrolys uppvisar väteklorid reducerande egenskaper:
MnO2 + 4 HCl → MnCl2 + Cl2 + 2 H2O
Vid uppvärmning oxideras väteklorid av syre (katalysator - koppar(II)klorid CuCl 2):
4 HCl + O2 → 2 H2O +2 Cl2
Men koncentrerad saltsyra reagerar med koppar för att bilda ett envärt kopparkomplex:
2 Cu + 4 HCl → 2 H + H2
En blandning av 3 volymdelar koncentrerad saltsyra och 1 volymdel koncentrerad salpetersyra kallas regiavatten. Aqua regia kan till och med lösa upp guld och platina. Den höga oxidativa aktiviteten hos aqua regia beror på närvaron i den av nitrosylklorid och klor, som är i jämvikt med utgångsämnena:
4 H 3 O + + 3 Cl − + NO 3 − = NOCl + Cl 2 + 6 H 2 O
På grund av den höga koncentrationen av kloridjoner i lösningen binder metallen till ett kloridkomplex, vilket främjar dess upplösning:
3 Pt + 4 HNO3 + 18 HCl → 3 H2 + 4 NO + 8 H2O
Klorväte kännetecknas också av additionsreaktioner till multipla bindningar (elektrofil addition):
R-CH=CH2 + HCl → R-CHCl-CH3
R-C≡CH + 2 HCl → R-CCl2-CH3
Kloroxider- oorganiska kemiska föreningar av klor och syre, med den allmänna formeln: Cl x O y.
Klor bildar följande oxider: Cl 2 O, Cl 2 O 3, ClO 2, Cl 2 O 4, Cl 2 O 6, Cl 2 O 7. Dessutom är följande kända: den kortlivade radikalen ClO, klorperoxidradikalen ClOO och klortetroxidradikalen ClO4.
Tabellen nedan visar egenskaperna hos stabila kloroxider:
Tabell 6
| Fast egendom | Cl2O | ClO2 | CLOClO 3 | Cl 2 O 6 (l)↔2ClO 3 (g) | Cl2O7 |
| Färg och skick i rummet. temperatur | Gulbrun gas | Gulgrön gas | Ljusgul vätska | Mörkröd vätska | Färglös vätska |
| Kloroxidationstillstånd | (+1) | (+4) | (+1), (+7) | (+6) | (+7) |
| T. pl., °C | −120,6 | −59 | −117 | 3,5 | −91,5 |
| Koktemperatur, °C | 2,0 | 44,5 | |||
| d(f, 0°C), g*cm-3 | - | 1,64 | 1,806 | - | 2,02 |
| ΔH°-prov (gas, 298 K), kJ*mol -1 | 80,3 | 102,6 | ~180 | (155) | |
| ΔG°-prov (gas, 298 K), kJ*mol -1 | 97,9 | 120,6 | - | - | - |
| S°-prov (gas, 298 K), J*K -1 *mol -1 | 265,9 | 256,7 | 327,2 | - | - |
| Dipolmoment μ, D | 0,78 ± 0,08 | 1,78 ± 0,01 | - | - | 0,72 ± 0,02 |
 Kloroxid (I), Dikloroxid, hypoklorsyraanhydrid - en förening av klor i oxidationstillståndet +1 med syre.
Kloroxid (I), Dikloroxid, hypoklorsyraanhydrid - en förening av klor i oxidationstillståndet +1 med syre.
Under normala förhållanden är det en brungul gas med en karakteristisk lukt som påminner om klor. Vid temperaturer under 2 °C är vätskan guldröd till färgen. Giftigt: påverkar andningsvägarna. Spontant sakta sönderfaller:
Explosivt vid höga koncentrationer. Densiteten under normala förhållanden är 3,22 kg/m³. Löser sig i koltetraklorid. Lösligt i vatten för att bilda svag hypoklorsyra:
Reagerar snabbt med alkalier:
Cl2O + 2NaOH (utspädd) = 2NaClO + H2O
Klordioxid- sur oxid. Vid upplösning i vatten bildas klor- och perklorsyror (disproportioneringsreaktion). Utspädda lösningar är stabila i mörker och sönderdelas långsamt i ljuset:
 Klordioxid- kloroxid ( IV), en förening av klor och syre, formel: ClO 2.
Klordioxid- kloroxid ( IV), en förening av klor och syre, formel: ClO 2.
Under normala förhållanden är ClO 2 en rödgul gas med en karakteristisk lukt. Vid temperaturer under 10 °C är ClO 2 en rödbrun vätska. Låg stabilitet, exploderar i ljus, vid kontakt med oxidationsmedel och vid upphettning. Låt oss lösa upp väl i vatten. På grund av dess explosionsrisk kan klordioxid inte lagras som vätska.
Sur oxid. Vid upplösning i vatten bildas klor- och perklorsyror (disproportioneringsreaktion). Utspädda lösningar är stabila i mörker och sönderdelas långsamt i ljuset:
Den resulterande klorsyran är mycket instabil och sönderdelas:
Uppvisar redoxegenskaper.
2ClO2 + 5H2SO4 (utspädd) + 10FeSO4 = 5Fe2 (SO4)3 + 2HCl + 4H2O
ClO2 + 2NaOH kall. = NaClO2 + NaClO3 + H2O
ClO 2 + O 3 = ClO 3 + O 2
ClO 2 reagerar med många organiska föreningar och fungerar som ett medelstarkt oxidationsmedel.
 Hypoklorsyra- HClO, en mycket svag monobasisk syra där klor har ett oxidationstillstånd på +1. Finns bara i lösningar.
Hypoklorsyra- HClO, en mycket svag monobasisk syra där klor har ett oxidationstillstånd på +1. Finns bara i lösningar.
I vattenlösningar sönderfaller hypoklorsyra delvis till en proton och hypokloritanjonen ClO − :
Instabil. Hypoklorsyra och dess salter - hypokloriter- starka oxidationsmedel. Reagerar med saltsyra HCl och bildar molekylärt klor:
HClO + NaOH (utspädd) = NaClO + H2O 
Klorsyra- HClO 2, en monobasisk syra med medelstyrka.
Klorsyra HClO 2 i sin fria form är instabil, även i en utspädd vattenlösning sönderdelas den snabbt:
Neutraliserad av alkalier.
HClO2 + NaOH (utspädd kall) = NaClO2 + H2O
Anhydriden av denna syra är okänd.
En sur lösning framställs av dess salter - kloriter bildas som ett resultat av interaktionen av ClO 2 med alkali:
Uppvisar redoxegenskaper.
5HClO2 + 3H2SO4 (utspädd) + 2KMnO4 = 5HClO3 + 2MnSO4 + K2SO4 + 3H2O
 Klorsyra- HClO 3, en stark monobasisk syra där klor har ett oxidationstillstånd på +5. Ej mottagen i fri form; i vattenlösningar vid koncentrationer under 30 % i kyla är den ganska stabil; i mer koncentrerade lösningar sönderdelas det:
Klorsyra- HClO 3, en stark monobasisk syra där klor har ett oxidationstillstånd på +5. Ej mottagen i fri form; i vattenlösningar vid koncentrationer under 30 % i kyla är den ganska stabil; i mer koncentrerade lösningar sönderdelas det:
Hypoklorsyra är ett starkt oxidationsmedel; oxidationskapaciteten ökar med ökande koncentration och temperatur. HClO 3 reduceras lätt till saltsyra:
HClO3 + 5 HCl (konc.) = 3Cl2 + 3H2O
HClO3 + NaOH (utspädd) = NaClO3 + H2O
När en blandning av SO 2 och luft leds genom en starkt sur lösning bildas klordioxid:
I 40 % perklorsyra antänds till exempel filterpapper.
8. Att vara i naturen:
I jordskorpan är klor den vanligaste halogenen. Eftersom klor är mycket aktivt förekommer det i naturen endast i form av föreningar i mineraler.
Tabell 7. Fynd i naturen
Tabell 7. Mineralformer
De största reserverna av klor finns i salterna i havens och havens vatten.
Mottagande
Kemiska metoder för att framställa klor är ineffektiva och dyra. Idag har de främst historisk betydelse. Kan erhållas genom att reagera kaliumpermanganat med saltsyra:
Scheele metod
Ursprungligen baserades den industriella metoden för att producera klor på Scheele-metoden, det vill säga reaktionen av pyrolusit med saltsyra:
Diakonmetoden
Metod för framställning av klor genom katalytisk oxidation av klorväte med atmosfäriskt syre.
Elektrokemiska metoder
Idag produceras klor i industriell skala tillsammans med natriumhydroxid och väte genom elektrolys av en lösning av bordssalt, vars huvudprocesser kan representeras av sammanfattningsformeln:
Ansökan
· Fönsterprofil tillverkad av klorhaltiga polymerer
· Huvudkomponenten i blekmedel är Labarraco-vatten (natriumhypoklorit)
· Vid tillverkning av polyvinylklorid, plastföreningar, syntetiskt gummi.
· Tillverkning av klororganiska ämnen. En betydande del av det klor som produceras konsumeras för att få fram växtskyddsmedel. En av de viktigaste insekticiderna är hexaklorcyklohexan (ofta kallad hexakloran).
· Används som ett kemiskt stridsmedel, samt för produktion av andra kemiska stridsmedel: senapsgas, fosgen.
· För vattendesinfektion - "klorering".
· Registrerad i livsmedelsindustrin som livsmedelstillsats E925.
· Vid kemisk produktion av saltsyra, blekmedel, bertholletsalt, metallklorider, gifter, droger, gödningsmedel.
· Inom metallurgi för framställning av rena metaller: titan, tenn, tantal, niob.
· Som en indikator på solneutriner i klor-argon-detektorer.
Många utvecklade länder strävar efter att begränsa användningen av klor i vardagen, bland annat för att förbränning av klorhaltigt avfall producerar en betydande mängd dioxiner.